
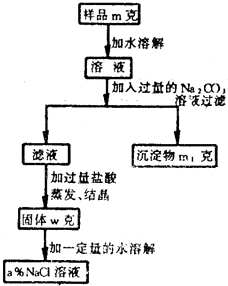
 欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案.根据方案中所示回答下列各问:
欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案.根据方案中所示回答下列各问:| wg |
| a% |
| wg |
| a% |
| wg |
| a% |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:2012届广东省广州市海珠区中考一模化学试卷(带解析) 题型:填空题
(7分)某氯化钾样品中含有少量氯化钙和氯化镁。以下是除去氯化钾样品中少量氯化钙和氯化镁的流程:
请回答:
(1)氯化钾样品的提纯
①KOH溶液与欲除去的杂质所发生反应的化学方程式是 。
②加入“试剂A”可除去氯化钾样品中的氯化钙,反应的化学方程式是
;验证氯化钙完全被除去的方法是
。
③加入“试剂B”的目的是 。
④“操作1”中要用到玻璃棒,其作用是 。
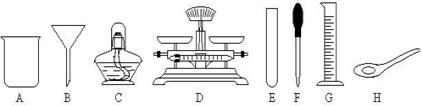
(2)用提纯的KCl固体配制200g10%的KCl溶液,需要KCl的质量为 g;配制时,需用到的玻璃仪器有烧杯、滴管、玻璃棒、 。
查看答案和解析>>
科目:初中化学 来源: 题型:
欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案。根据方案中所示回答下列各问:
⑴称量粗盐样品m克,在托盘天平左盘上放 右盘上放 。
⑵过滤时,漏斗下端管口应 ,漏斗里不夜面应 。
⑶蒸发操作时应将液体放在 中加热,等出现 时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液中作用是 ,反应的化学方程式是 。
⑸在滤液中加入过量盐酸的作用是 ,反应的化学方程式是 。
⑹配制a%的NaCl溶液时,加入水的质量是 ,配制时应在 中进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com