
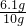 ×100%=61%;
×100%=61%;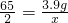


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:梅州 题型:问答题
查看答案和解析>>
科目:初中化学 来源: 题型:
黄铜是Cu和Zn合金,可用于制造各种仪器零件。为测定黄铜的组成,课外活动小组的同学取黄铜样品10g放人烧杯中,滴入稀硫酸至不再产生气泡时,测得消耗了稀硫酸30g,烧杯中剩余固体质量6.1g。请回答:
(1)测定过程中发生反应的化学方程式为 。
(2)烧杯中剩余固体的成分为 ;黄铜样品中cu的质量分数为 。
(3)求反应后烧杯中所得溶液的质量。
查看答案和解析>>
科目:初中化学 来源:2011年广东省梅州市中考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com