
【题目】(10分)某学校化学兴趣小组的同学想测定赤铁矿中氧化铁的含量,做了如下实验:首先称取100 g该赤铁矿样品放入烧杯中,然后将500g的稀盐酸分5次加入烧杯内(假设其余杂质均不与盐酸反应也不溶于水)进行充分反应.实验过程中的数据记录如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
稀盐酸的质量 | 100g | 100g | 100g | 100g | 100g |
溶液的质量 | 116.0g | X | 348.0g | 464.0g | 575.0g |
请回答下列问题:
(1)该小组要用质量分数为36.5%浓盐酸配制所需的500g的稀盐酸,则需浓盐酸的质量为_____
(2)写出实验中发生反应的化学方程式____________________
(3)列出求解生成氯化铁总质量的比例式____________________
(4)将第二次反应后所得溶液蒸发掉32g水(未达到饱和),则所得溶液的溶质质量分数是________
(5)某工厂要想制得420t含杂质3%的生铁,需要这种赤铁矿的质量为___________
【答案】(1)300g;(2) Fe2O3 + 6HCl = 2FeCl3 + 3H2O ;
(3) ![]() ;(4)32.5%;(5)776t.
;(4)32.5%;(5)776t.
【解析】
试题分析:由题知,发生的反应为氧化铁与盐酸反应生成氯化铁和水,所以反应后溶液增加的质量就是盐酸反应的氧化铁的质量.由第一次加入100g盐酸反应后,溶液的质量变为了116g,所以反应了16g氧化铁,因为在第四次加入100g盐酸反应后,溶液质量比第三次溶液质量增加了16g,所以说明在第三次、第二次、第一次加入100g盐酸后,盐酸均完全反应而氧化铁有剩余.
解:第一次加入盐酸后反应的氧化铁的质量为116g-100g=16g.
设所用稀盐酸溶液的溶质质量分数为X.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
219
16g 100﹒X
![]()
解得X=21.9%
设:需要浓盐酸的质量为Y.则有36.5%﹒Y=21.9%×500g,解得X=300g.
(2)该反应的化学方程式为Fe2O3 + 6HCl = 2FeCl3 + 3H2O
(3)因为第五次加入100g盐酸后,溶液的质量增加了575g-464g=11g<16g,所以此时氧化铁已经完全反应了,而盐酸有剩余,即反应的氧化铁的总质量为575g-500g=75g.
设:完全反应后生成氯化铁的质量为M.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
160 325
75g M
可以得到求解氯化铁的计算式为![]() .
.
(4)当第二次加入盐酸完全反应后,共反应的氧化铁的质量为16g×2=32g,此时得到的溶液质量为100g+100g+32g=232g,若再蒸发32g水,则最终得到的溶液的质量为200g.
设:第二次反应后生成的氯化铁的质量为N.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
160 325
32g N
![]()
解得N=65g.
故所得溶液的溶质质量分数为:
![]() .
.
(5) 420t含杂质3%的生铁中含铁的质量为420t×(1-3%)=407.4t.
设:要得到407.4t的铁所需氧化铁的质量为P.
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
P 407.4t
![]()
解得P=582t.
因为100g矿石中含氧化铁的质量为75g,所以此矿石中氧化铁的质量分数为75%,所以生产420t含杂质3%的生铁所需该赤铁矿的质量为582t÷75%=776t.


科目:初中化学 来源: 题型:
【题目】同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】
(1)A、B、C、D四组同学分别进行了下列实验
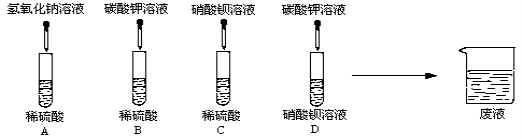
写出下列的两个化学方程式:
①A中的反应 。
②D中的反应 。
【挖掘实质】
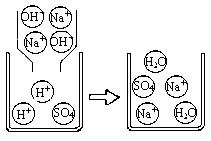
下图是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O
【实践运用】
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(1)①溶液中的白色沉淀一定是 ,理由是 。
(2)废液中一定不含有的离子是 。
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有 | ②取滤液滴加 | 现象明显 | 含有该离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用相应的化学符号填空:
(1)2个氢原子 (2)五氧化二氮分子
(3)食盐水中的溶质 (4)地壳中含量最高的金属元素
(5)硫酸根离子 (6)氯化镁中镁元素的化合价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【改编】(9分)A~F分别是氢气、氧气、氮气、一氧化碳、水、甲烷六种物质中的一种,请回答下列问题。
(1)C中两种元素的质量比为3:1。则C的化学式为_ 。
(2)C与D分别在B中燃烧均能生成F,F为相对质量最小的氧化物;在一定条件下,A和D反应能生成C和F。请写出下列物质的化学式:A为 ,D为 。
(3)根据以上的推断,请写出下列两个反应的化学方程式:
A与D反应: ;
请写出物质E的一种用途: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们已学习了简单的物质分类,以下物质中既属于纯净物又属于氧化物的是
A.充分加热氯酸钾和二氧化锰后的剩余固体
B.水和冰的混和物
C.石油
D.洁净的空气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20 ℃时,向l00 g未知浓度的KCl溶液中加入6 g KCl 后,一定正确的是
A.溶液质量变为106 g B.溶质质量发生变化
C溶液浓度变大 D.溶剂质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】卫生部门建议,对高度怀疑或已确诊H7N9型禽流感病例尽早使用“达菲”抗流感药物。达菲的化学式是C16H31N2PO8,则下列说法正确的是
A.达菲属于有机物
B.达菲中氢元素的质量分数最大
C.达菲中碳、氢两种元素的质量比是16∶31
D.一个达菲分子中含有一个氮分子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【改编】(7分)化学实验室要从含有少量铜粉的银、锰(![]() )混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
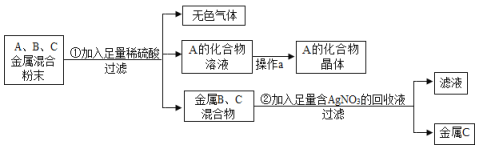
请回答:
(1)金属C是 ,A、B、C三种金属的活动性顺序为 。
(2)已知A的化合物中A元素显+2价,写出步骤①中反应的化学方程式: (2分);写出步骤②中反应的化学方程式: 。
(3)操作a是 ;有同学觉得过于复杂, (能或者不能)只加入足量AgNO3溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)有A、B、D、E四种元素,A是地壳中含量最多的金属元素,D元素原子核内只有一个质子,E元素形成的单质中有一种具有类似足球状的结构。已知D元素和E元素组成的化合物M,M的1个分子由5个原子构成;B、D和E三种元素能形成一种化合物R,R属于可再生能源,在汽油中加入适量R,可节省石油资源,减少汽车尾气对大气的污染。请回答下列问题:
(1)A、B和D三种元素形成的化合物的化学式为 ;
(2)R的化学式为 ;
(3)M在空气中燃烧的化学方程式为 ;
(4)E和B形成的化合物能跟单质E发生吸热反应,化学方程式为 ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com