
下列过程中,不涉及化学变化的是( )
A.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
B.在蒸馒头时,加入适量的纯碱使馒头疏松多孔
C.烧菜用过的铁锅,经常出现红棕色斑迹
D.家庭自制冰块
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
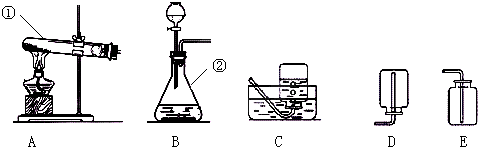
| ||
| ||
| ||
| ||
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ② 没有气泡冒出 没有气泡冒出 |
①样品中含有: 氢氧化钙 氢氧化钙 ②样品中不含有碳酸钙. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(黑龙江大庆卷)化学(解析版) 题型:计算题
现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下: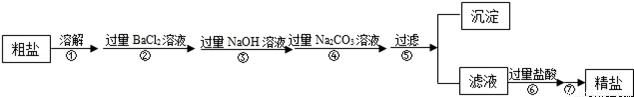
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 .
(2)请写出实验步骤②中所涉及的化学方程式 .
(3)步骤⑥中加入过量盐酸的目的是 .
(4)步骤②和步骤④ (填“可以”或“不可以”)颠倒,理由是 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 .
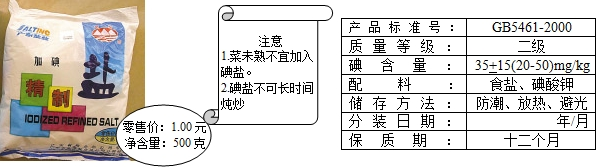
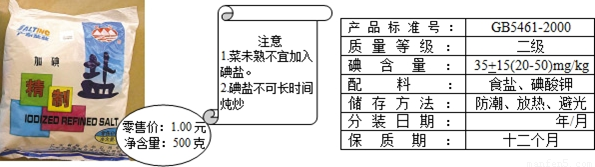
(6)加碘食盐相关信息如图所示.

食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(黑龙江大庆卷)化学(解析版) 题型:计算题
现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 .
(2)请写出实验步骤②中所涉及的化学方程式 .
(3)步骤⑥中加入过量盐酸的目的是 .
(4)步骤②和步骤④ (填“可以”或“不可以”)颠倒,理由是 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 .
(6)加碘食盐相关信息如图所示.
食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:
现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 .
(2)请写出实验步骤②中所涉及的化学方程式 .
(3)步骤⑥中加入过量盐酸的目的是 .
(4)步骤②和步骤④ (填“可以”或“不可以”)颠倒,理由是 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 .
(6)加碘食盐相关信息如图所示.

食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com