
【题目】高铁的开通对丹东的发展起到极大的推动作用。高铁建设需要大量的钢铁材料.
(1)工业炼铁的原理方程式是_________(以赤铁矿为例)
(2)锰钢是一种合金,可用于高铁建设。已知金属活动性:锰>铁.锰的部分化合物溶解性见右表。若用实验验证铁、铜、锰三种金属的活动性,至少需要的三种试剂是_________
OH- | NO3- | Cl - | SO42- | CO32- | |
Mn2+ | 不 | 溶 | 溶 | 溶 | 不 |
(3)已知铁的硬度为5,锰的硬度为6,锰钢的硬度__(填“>6”、“<5”或“介于5-6之间”).
【答案】Fe2O3 + 3CO![]() 2Fe+3CO2 硫酸锰溶液、硫酸铜溶液、铁(合理答案均可) >6
2Fe+3CO2 硫酸锰溶液、硫酸铜溶液、铁(合理答案均可) >6
【解析】
(1)赤铁矿的主要成分是氧化铁,在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3 + 3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)在金属活动性顺序中,氢之前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,设计实验证明金属的活动性顺序,可以使用活动性居中的金属为单质、强和弱的金属为盐溶液的方法,或是活动性居中的金属为盐海液,强和弱的金属为单质的方法,也可以使用加酸观察是否产生气体的方法。因此可以选择硫酸锰溶液、硫酸铜溶液和铁;或锰、铜和硫酸亚铁溶液;
(3)一般合金的硬度大于其组成中纯金属的硬度,所以锰钢的硬度大于铁与锰的硬度,即锰钢的硬度>6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】分析推理是化学学习过程中的常用方法,下列推理中,正确的是( )
A.化学变化中常有颜色的变化,所以有颜色的变化一定是化学变化
B.O 2﹣、Na+、Mg2+、Cl﹣的最外层电子数均为 8,所以 离子的最外层电子数均为 8
C.化学反应伴随能量变化,所以金属腐蚀过程中有能量变化
D.稀有气体化学性质不活泼,所以化学性质不活泼的气体一定是稀有气体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~I均为初中化学常见物质,它们之间的转化关系如下图,部分产物已略去。已知A是人体胃酸的主要成分,B是大理石的主要成分,D为液体,F为气体,I能与A反应生成个数比为1 : 2的+2价、+3价铁盐。
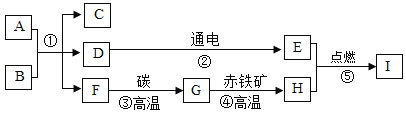
(1)写出下列物质的化学式:C_____________、H________________。
(2)上述①②③④⑤中属于化合反应的是_______________。
(3)写出G→H的化学反应方程式_______________。
(4)写出I和A反应的化学反应方程式_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是元素周期表中氯、铁两种元素的相关信息,下列说法错误的是( )
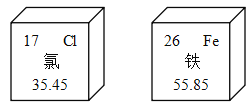
A.氯原子的核外电子数是 17
B.铁原子的核电荷数是 26
C.氯的相对原子质量是 35.45
D.这两种元素只能形成一种化合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学活动小组准备测定生成O2 的体积并探究影响反应速率的因素。
(实验一)通过下列实验,利用二氧化锰粉末与过氧化氢溶液反应来测定生成 O2 的体积。
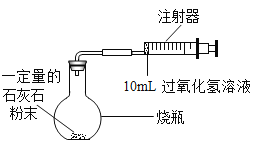
(1)实验中,先连接好装置后检查装置的气密性,然后装好药品,最后将 10mL 过氧化氢溶液_______(填“快速”或“缓慢”)推入烧瓶中,如果不这样操作,则可能造成的后果是_________。
(实验二)探究 H2O2 质量分数、溶液 pH、温度对反应速率的影响。设计如下表实验方案:
实验序号 | H2O2 质量分数 | pH | 温度/℃ | 30s 内收集到氧气的体积 |
1 | 25 | 5 | 20 | |
2 | 25 | 6 | 20 | |
3 | 25 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
(2)实验 1~3 的实验目的是_____。
(3)a=_____;b=_____。
(实验三)探究催化剂对化学反应速率的影响:
取 5mL 溶质质量分数相同的 H2O2 溶液,三次实验分别加入质量均为 0.5gMnO2、红砖粉末、CuO 进行实验,记录收集相同体积氧气所用时间的数据如下:
试剂
MnO2
红砖粉末
CuO
时间/s
10
60
20
由此得出结论:MnO2、CuO 对 H2O2 分解有催化作用,红砖粉末无催化作用。
(4)你认为该结论是否正确?_____(填“正确”或“不正确”),为什么?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下图装置可在实验室制取氢气、氧气、二氧化碳气体。


(1)既可用A装置又可用B装置制取的气体是________,写出用A装置制取气体的一个化学方程式______。
(2)既可用B装置又可用F装置制取的气体是_______,与B装置相比,F装置优点是 ______。
(3)要收集体积比为2:1的氢气和氧气的混合气体,应选择的收集装置是______。
(4)加热氯化铵和熟石灰的固体混合物可制取氨气(NH3)。氨气极易溶于水形成氨水,制取氨气应选用的一套装置是_________(填字母代号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国的煤炭资源丰富,但液体燃料短缺。通过“煤液化”技术,用煤炭和水制取甲醇(CH3OH)对我国具有重要意义。主要流程如下:

(1)冷却器里发生的是_____ (填“物理”成“化学”)变化。
(2)合成塔中发生反应的微观示意图如下,请在方框内补全相应微粒的图示。_____

(3)下列关于甲醇生产的说法中,合理的是_____ (填字母序号)
A 根据信息推测,甲醇是一种液体燃料
B 煤炭与水在常温下即可生成CO和H2
C 甲醇的生产会受到CO和H2比例的影响
(4)甲醇(化学式: CH3OH)是一种重要的工业原料。甲醇由_____种元素组成;碳、氢元素的物质的最之比为_____;甲醇的摩尔质量是_____;甲醇中碳元素的质量分数为_____;3.2g 甲醇中含_____个甲醇分子。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A-G是初中化学常见的物质,其中A为难溶性钙盐,B为酸,G为微溶性碱,D为气体单质,C、E、F为氧化物,H是一种有机化合物。已知各物质间能发生下图所示的系列变化:
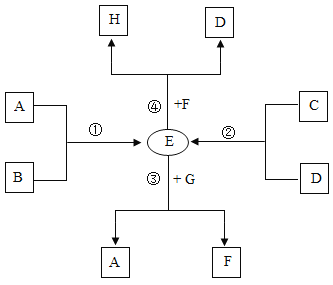
请回答:
(1)反应①的化学方程式____________________________________。
(2)反应②的基本反应类型____________________________________。
(3)反应③的一条用途____________________________________。
(4)反应④的能量转化____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产生活中有广泛应用。
(1)共享单车作为代步工具,既轻便灵活,又环保。如图是一款自行车的图片,所标材料中,车架主要含有的金属元素是_______________,铝合金与纯铝相比,其硬度更________________(填“大”或“小”)。
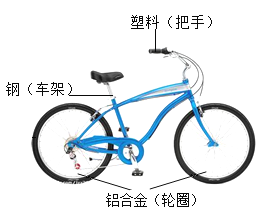
(2)赤铁矿(主要成分Fe2O3)是炼铁的一种矿石,Fe2O3属于______________(填“单质”或“氧化物”)。我国是使用“水法冶铜”最早的国家,请写出铁和硫酸铜溶液反应的化学方程式_______________。
(3)为了验证Fe、Cu、Ag三种金属的活动性顺序,下列选用的药品可行的是______________(填序号)。
①Fe、CuSO4溶液、Ag
②FeSO4溶液、Cu、Ag
③FeSO4溶液、Cu、AgNO3溶液
④FeSO4溶液、CuSO4溶液、Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com