
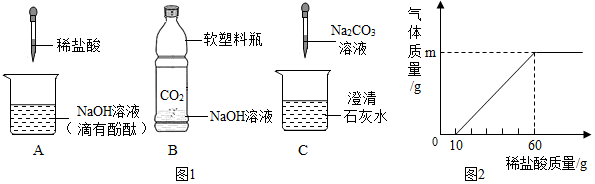
| 学生甲 | 可能含有Ca(OH)2 | 学生乙 | 可能含有Na2CO3 |
| 学生丙 | 可能含有CaCl2 | 学生乙 | 可能含有NaOH |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡 | 有白色沉淀生成 | 说明原溶液中一定有碳酸钠 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液 | 溶液变红色 | 说明原溶液中一定有氢氧化钠 |
分析 (1)酚酞的作用是判断氢氧化钠和稀盐酸是否反应;
(2)二氧化碳与氢氧化钠反应使塑料瓶的气体减少,从而使瓶内气压变小,在外界大气压的作用下塑料瓶变瘪;
(3)碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
【假设猜想】废液浑浊是因为碳酸钠溶液与石灰水反应生成了碳酸钙沉淀;稀盐酸与氢氧化钠溶液反应生成了氯化钠,氯化钠不再与其他物质反应;
【实验验证】向滤液中逐滴加入氯化钡溶液,得到白色沉淀,在废液中能与氯化钡反应生成沉淀的只有Na2CO3.由于碳酸钠的存在,所以溶液中不存在能够和碳酸钠反应的Ca(OH)2和CaCl2;由于本身混有酚酞,沉淀后的溶液的红色褪去,所以溶液中不可能含有NaOH,加氯化钡前溶液显红色是因为碳酸钠溶液显碱性导致的;
【实验反思】(1)氢氧化钠溶液露置于空气中容易与二氧化碳反应生成碳酸钠和水.
【查阅资料】(1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,因碳酸钠与氯化钡能生成碳酸钡沉淀,所以有白色沉淀生成,说明原溶液中一定有碳酸钠.
(2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液,溶液变红色,溶液显碱性,因溶液中碳酸钠已被氯化钡完全消耗;
[实验结论]氢氧化钠溶液部分变质.
【反思与评价】(1)氢氧化钙与碳酸钠反应会生成氢氧化钠,这样无法确定(2)步骤的实验结论;
【定量探究】根据题中信息可以知道消耗盐酸的质量,然后根据盐酸和碳酸钠反应的化学方程式可以计算出碳酸钠的质量,进而求算出碳酸钠的质量分数.
解答 解:(1)A实验中滴加酚酞的作用是判断氢氧化钠和稀盐酸是否反应,故填:判断氢氧化钠和稀盐酸是否反应;
(2)因为二氧化碳与氢氧化钠反应使塑料瓶的气体减少,从而使瓶内气压变小,在外界大气压的作用下塑料瓶变瘪,因此B实验中观察到的现象为塑料瓶变瘪,故填:塑料瓶变瘪;
(3)碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
【假设猜想】废液浑浊是因为碳酸钠溶液与石灰水反应生成了碳酸钙沉淀;稀盐酸与氢氧化钠溶液反应生成了氯化钠,氯化钠不再与其他物质反应.故一定含有:NaCl;溶液显红色,还有可能含有氢氧化钠,故填:氯化钠;NaOH;
【实验验证】向滤液中逐滴加入氯化钡溶液,得到白色沉淀,在废液中能与氯化钡反应生成沉淀的只有Na2CO3.故一定含有:Na2CO3;
由于碳酸钠的存在,所以溶液中不存在能够和碳酸钠反应的Ca(OH)2和CaCl2,一定没有:Ca(OH)2和CaCl2;故一定没有:Ca(OH)2和CaCl2;
由于本身混有酚酞,沉淀后的溶液的红色褪去,所以溶液中不可能含有NaOH,加氯化钡前溶液显红色是因为碳酸钠溶液显碱性导致的;故一定没有NaOH;
综上所述,滤液中一定还含有 Na2CO3; 一定不含有 CaCl2、Ca(OH)2、NaOH.
故填:Na2CO3; CaCl2、Ca(OH)2、NaOH.
【实验反思】(1)氢氧化钠溶液露置于空气中容易与二氧化碳反应生成碳酸钠和水,相关反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O.故填:CO2+2NaOH═Na2CO3+H2O.
【查阅资料】(1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,因碳酸钠与氯化钡能生成碳酸钡沉淀,所以有白色沉淀生成,说明原溶液中一定有碳酸钠.
(2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液,溶液变红色.溶液显碱性,因溶液中碳酸钠已被氯化钡完全消耗,所以说明原溶液中一定有氢氧化钠.
故填:白色沉淀;氢氧化钠;
[实验结论]该氢氧化钠溶液部分变质.
【反思与评价】
(1)如用氢氧化钙溶液代替氯化钙溶液是不行的,因为氢氧化钙与碳酸钠反应会生成氢氧化钠,这样无法确定(2)步骤的实验结论,得不出氢氧化钠部分变质的结论,所以该方案不可行,故填:不可行;
【定量探究】:
(1)由题意可以知道消耗的盐酸中溶质的质量为:(60g-10g)×7.3%=3.65g;
设原溶液中碳酸钠的质量为x,生成二氧化碳的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x 3.65g y
$\frac{106}{x}$=$\frac{73}{3.65g}$=$\frac{44}{y}$,解得:x=5.3g,y=2.2g,
即m的值为2.2,故填:2.2;
(2)原溶液中碳酸钠的质量分数为:$\frac{5.3g}{50g}$×100%=10.6%,故答案为:10.6%.
点评 此题是一道实验探究题,解题的关键是把握在证明氢氧化钠部分变质时,先除去氢氧化钠中的碳酸钠,然后再证明剩余溶液显碱性,才能说明氢氧化钠部分变质.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 蛋白质 | B. | 油脂 | C. | 淀粉 | D. | 维生素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 结合水和溶液的相关知识,回答下列问题:
结合水和溶液的相关知识,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
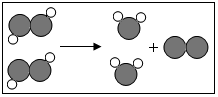 如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )
如图为某反应的微观示意图,不同的球代表不同元素的原子.下列说法错误的是( )| A. | 该反应的反应物可能属于氧化物 | |
| B. | 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应 | |
| C. | 该反应的反应类型为分解反应 | |
| D. | 该反应生成物都属于化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 地球上水储量丰富,而且大部分是可供利用的淡水 | |
| B. | 水的生成和分解的实验,都可说明水是由氧分子组成的 | |
| C. | 在水电解反应中,氢原子和氧原子都没有发生变化 | |
| D. | 在水电解实验中,与电源正极相连的玻璃管内得到的气体能在空气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com