
(7分)菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2S04溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(1)4.4g
(2)菱镁矿中镁元素的质量分数为24%。
(3)9.8%
(4)作图见下图曲线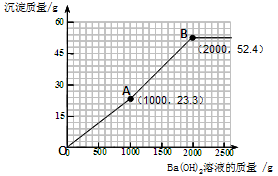
解析试题分析:(1)碳酸镁可与稀硫酸反应生成二氧化碳气体,氢氧化钠可与二氧化碳气体反应。所以氢氧化钠溶液增重的质量即为反应生成的二氧化碳的质量。由于氢氧化钠溶液增重的质量最大值为4.4g。所以生成CO2的质量为4.4g。
(2)根据题意可知:已知量为生成二氧化碳的质量;未知量为菱镁矿中镁元素的质量分数。解题思路:可根据二氧化碳与碳酸镁在反应体系中的质量关系,求出碳酸镁的质量。再进一步可计算出菱镁矿中镁元素的质量分数。具体过程如下:
解:设菱镁矿中MgCO3的质量为x。
MgCO3+H2SO4=MgSO4+H2O+CO2↑
84 44
x 4.4g
84∶44=x∶4.4g
x = 8.4g
菱镁矿中镁元素的质量分数=[(8.4g×24/84)÷10g]×100%=24%
答:该菱镁矿中镁元素的质量分数为24%。
(3)根据表格中的数据可知:第一、二两次中的硫酸完全反应,所以可根据第一、二两次中二氧化碳的质量计算出参加反应的硫酸的质量,进一步计算出硫酸的质量分数。具体过程如下:
解:设所用H2SO4溶液的溶质的质量分数为y
MgCO3+H2SO4=MgSO4+H2O+CO2↑
98 44
100gy 4.4g
98:44=100gy:4.4g
y = 9.8%
所用H2SO4溶液的溶质的质量分数为9.8%。
(4)加入的氢氧化钡可先与过量的稀硫酸反应。由于过量的稀硫酸中硫酸的质量为(200g—100g)×9.8%= 9.8g。根据反应的化学方程式可计算出:可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g。所以图像中的第一个折点的坐标为(1000,23.3 )。
再加入的氢氧化钡与硫酸镁反应。根据反应的化学方程式可计算出:硫酸镁的质量为12 g,可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g,生成氢氧化镁沉淀的质量为5.8 g。因此图像中的第二个折点所用的氢氧化钡溶液的质量为1000 g+1000 g=2000 g。同时沉淀的质量为23.3 g+23.3 g+5.8 g=52.4 g。所以图像中的第二个折点的坐标为(2000,52.4)。
再加入氢氧化钡时,不再产生沉淀。可根据规律进行描点和画图为: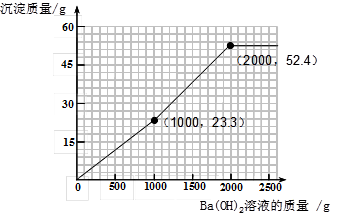
考点:根据化学方程式的计算


科目:初中化学 来源: 题型:单选题
在反应3X+4Y=2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为
| A.27 | B.70 | C.108 | D.1 72 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
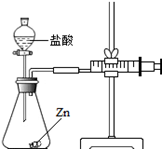
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
中和反应在工农业生产中应用广泛,现向40g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图),请分析计算:
(1)40g 10%的氢氧化钠溶液中含有 4 g的氢氧化钠;当滴入36.5g盐酸时,溶液的pH为 7 .
(2)所用盐酸的溶质质量分数(写出计算过程).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验后的废液一般需回收处理,不能直接倒入排污管。小科实验后收集到含有碳酸钠和氧氧化钠的混合废液10.22g,他向废液中缓缓滴入溶质质量分数为19.6%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示。当废液恰好处理完毕时,溶液总质量为20g。溶于水的气体忽略不计,则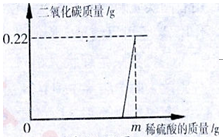
(1)废液恰好处理完毕时.溶液的pH为 。
(2)图中m= g。
(3)废液恰好处理完毕时,回收所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分) “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,进行实验。取10 g样品加入50 g稀硫酸中,恰好完全反应,称量剩余物为59.9g。
求:(1)产生氢气的质量 。
(2)计算黄铜样品中铜的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如下:
(1)过程①中发生的反应属于_______反应(选填“化合”、“分解”、“置换”、“复分解”之一),过程③是利用了一氧化碳的______(选填“氧化性” “还原性”之一)。
(2)列举一例防止钢铁锈蚀的具体措施:________________________________。
(3)试用化学方程式计算:该企业用 1000t 含氧化铁 80%的赤铁矿可炼得金属铁多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)某工厂化验室用氢氧化钠溶液中和一定量石油产品中的残余硫酸至中性,共消耗5%的氢氧化钠溶液80g。这一定量石油产品中含H2SO4的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com