
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
科目:初中化学 来源: 题型:
现用 98%的浓硫酸配1000mL 溶质质量分数为 20% 的稀硫酸 ( 密度为 1.14g/mL).下列说法不正确的是
A. 实验中需要用到的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管等
B. 配制该稀硫酸需要加水 800mL
C. 配制时应将浓硫酸小心地加入水中
D. 该稀硫酸中,溶液质量:溶剂质量 =5:4
查看答案和解析>>
科目:初中化学 来源: 题型:
2012年1月,广西龙江河发生了镉浓度超标事件。根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动。查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价
②水体中镉元素通常以氯化镉的 形式存在 ③氯化镉能溶于水
形式存在 ③氯化镉能溶于水
(一)金属镉与铜、银活动性顺序的探究
| 实验步骤 | 实验现象 | 实验结论 |
| 取适量镉、铜、银于试管中,加入足量稀硫酸 | 镉表面有气泡产生,铜、银表面无气泡产生 | ____________________ |
| 取适量铜于试管中,加入少量硝酸银溶液 | , 。 | 铜的活动性大于银 |
实验结论:镉、铜、银活动性顺序:___________________________;
【回答问题】
(1)实验之前都要用砂纸打磨金属片的目的是____________________________;
(2)写出铜与硝酸银反应的化学方程式__________________________________;
(3)小芳认为只要选用三种药品进行实验就能得出上述三种金属的活动性大小,这三种药品可以是________________________________________。(2分)
查看答案和解析>>
科目:初中化学 来源: 题型:
Ⅰ.利用海水淡化后母液中含有的氯化镁和海边盛产的贝壳(主要成分CaCO3),制取金属镁,生产大致流程如下图所示:

(1)请写出母液中氯化镁转化为氢氧化镁的化学方程式: 。
(2)操作a的名称是____________。
(3)工业上常以氯化镁为原料,电解就可以生产金属镁 。反应的化学方程式为MgCl2
。反应的化学方程式为MgCl2 Mg+X。X的化学式是_______。
Mg+X。X的化学式是_______。
Ⅱ.阅读下列两段材料,回答问题:
材料一:1811年法国药剂师库特瓦首次发现单质碘。单质碘呈紫黑色晶体,易升华,升华后易凝华。有毒性和腐蚀性。碘单质遇淀粉会变蓝紫色,可以用作鉴别淀粉的定量和定性的方法。人们可以从海藻中提取碘,也可以从智利硝石、生硝、海水、盐井中获得。
 材料二:碘元素在周期表中信息如图3所示。生活中将碘(I2)溶解在酒精中配
材料二:碘元素在周期表中信息如图3所示。生活中将碘(I2)溶解在酒精中配
制成碘酒,用于消毒;在食盐中加入碘酸钾(KIO3)制成碘盐,用于预防碘缺乏病。
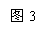 但碘酸钾与氯酸钾相似,加热会分解,生成碘化钾和氧气。
但碘酸钾与氯酸钾相似,加热会分解,生成碘化钾和氧气。
(1)碘属于 元素(填“金属”或“非金属”)。
 (2)碘原子的结构示意图如图4所示,推算x= ,在化学反应中
(2)碘原子的结构示意图如图4所示,推算x= ,在化学反应中
容易 电子(填“得”或“失”),形成的微粒符号是______。
(3)根据上述材料,总结下列有关知识:
碘的物理性质(写一点) ;
碘酸钾的化学性质(用化学方程式表示) ;
 烧菜使用加碘盐要注意 。
烧菜使用加碘盐要注意 。
查看答案和解析>>
科目:初中化学 来源: 题型:
25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:初中化学 来源: 题型:
向1.0 L 0.30 mol·L-1的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.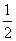 c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO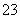 )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO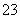 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:初中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH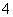 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
)某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管向其中滴加5 mL盐酸。试回答下列问题:

(1)实验中观察到的现象是________________________________________________________________________
________________________________________________________________________。
(2)产生上述现象的原因是________________________________________________________________________
________________________________________________________________________。
(3)写出有关反应的离子方程式:________________________________________________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25 ℃的饱和石灰水”换成“20 ℃碳酸饮料”进行实验探究,实验中观察到的另一现象是______________________________________________________,
其原因是____________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
某温度时,N2+3H22NH3的平衡常数K=a,则此温度下,NH33/2H2+1/2N2的平衡常数为( )
A.a-1/2 B.a1/2
C.a D.a-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com