
| 氧化钾 | 氧化钙 | 氧化钠 | 氧化镁 | 氧化铝 | 氧化锌 | 氧化铁 | 氧化铜 |
| K2O | CaO | Na2O | MgO | Al2O3 | ZnO | Fe2O3 | CuO |
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |

| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
| ||
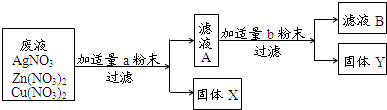
 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 | |
| 小华的实验 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢分解速率很慢 常温下过氧化氢分解速率很慢 |
装有过氧化氢溶液的试管中加入少量Al2O3 装有过氧化氢溶液的试管中加入少量Al2O3 然后将带火星的木条伸入试管中 然后将带火星的木条伸入试管中 |
木条复燃 | Al2O3能加快H2O2溶液的分解速率 | |
| 小明的实验 | 在一支试管中加入H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | 迅速产生大量气泡 迅速产生大量气泡 带火星的木条复燃 带火星的木条复燃 |
FeCl3溶液加快H2O2溶液的分解速率 |
| 实验过程 | 实验现象 | 结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管. |
无明显现象 | Cl-不能催化分解H2O2 Cl-不能催化分解H2O2 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的 Fe(NO3)3溶液 Fe(NO3)3溶液 ,并把带火星的木条伸入试管. |
试管中有大量气泡产生,带火星的木条复燃 试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ 起催化作用的是Fe3+ |
查看答案和解析>>
科目:初中化学 来源:专项题 题型:填空题

查看答案和解析>>
科目:初中化学 来源:2012-2013学年广东省汕头市雷岭中学九年级(上)第三学月考化学试卷(解析版) 题型:填空题
| 实验步骤 | 实验现象 | 实验结论 | |
| 小华的实验 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | |
| | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 | |
| 小明的实验 | 在一支试管中加入H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | | FeCl3溶液加快H2O2溶液的分解速率 |
| 实验过程 | 实验现象 | 结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管. | 无明显现象 | |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的 ,并把带火星的木条伸入试管. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com