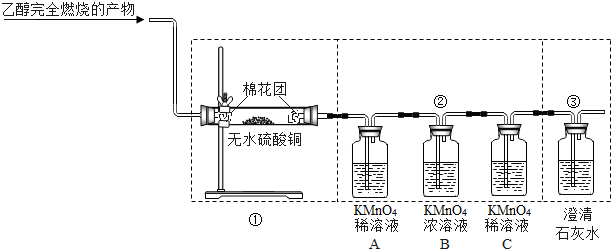
解:【提出猜想】乙硫醚由碳、氢、硫三种元素组成,因此猜想乙硫醇完全燃烧的产物是水、二氧化碳和二氧化硫,是依据反应前后元素的种类保持不变或质量守恒定律进行的猜想;
【现象与结论】①利用硫酸铜固体遇水变蓝色的性质,观察到白色固体硫酸铜固体变成蓝色,可说明混合物中含有水;
②利用KMnO
4溶液吸收二氧化硫褪色,观察到A瓶内溶液褪色可说明混合物中含有二氧化硫气体;
③由于二氧化硫也能使澄清石灰水变浑浊,会影响对二氧化碳的检验,因此让气体先通过浓高锰酸钾溶液进行吸收,并再次使用C瓶内的稀高锰酸钾溶液检验后,气体通入澄清石灰水,因此除观察到石灰水变浑浊外,还要注意到组合②C装置中观察到KMnO
4溶液不褪色,这样才能说明混合物中含有二氧化碳;
【实验反思】(1)装置互换后,混合气体通过高锰酸钾稀溶液时会含有水,则无法检验混合气体中是否含有H
2O;
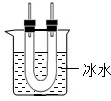
(2)混合物中的水若遇冷也变成液体,影响对三氧化硫的检验,因此该装置应放在检验水存在的装置①之后;若该装置放在气体通过溶液后进行检验,通过溶液的气体中混入的水又将影响三氧化硫的检验,因此该装置应放在进行二氧化硫检验时所使用的装置②之前;
(3)乙硫醇完全燃烧的产物是水、二氧化碳和二氧化硫,反应的化学方程式为2C
2H
6S+9O
2
2SO
2↑+4CO
2↑+6H
2O.
故答案为:
【提出猜想】反应前后元素的种类保持不变或质量守恒定律;
【现象与结论】①白色固体变成蓝色;②KMnO
4溶液褪色;③组合②C装置中观察到KMnO
4溶液不褪色;
【实验反思】(1)H
2O;(2)①和②;(3)2C
2H
6S+9O
2
2SO
2↑+4CO
2↑+6H
2O.
分析:【提出猜想】乙硫醇完全燃烧的产物是水、二氧化碳和二氧化硫,对比猜想中各物质的组成元素,可推断出猜想所依据的是反应前后元素的种类保持不变或质量守恒定律;
【现象与结论】①白色固体硫酸铜固体遇水变成蓝色,利用这一特点可检验混合物中的水;
②二氧化硫气体能使KMnO
4溶液褪色,利用这一性质可使用高锰酸钾溶液检验混合物中的二氧化硫气体;
③组合②B装置盛放的浓高锰酸钾溶液吸收二氧化硫,若观察到C装置中KMnO
4溶液不褪色,可说明通入澄清石灰水的气体中不含有同样能使石灰水变浑浊的二氧化硫气体,以确定对二氧化碳气体的检验;
【实验反思】(1)装置顺序更换后,通过溶液的气体中会混H
2O,影响了硫酸铜对原混合物中水的检验;
(2)根据资料“三氧化硫(SO
3)在常温(25
0C)下是液态”,可采取对混合气体在处理水后进行降温,观察是否有液体出现,以检验三氧化硫;
(3)根据乙硫醇完全燃烧的产物是水、二氧化碳和二氧化硫,完成乙硫醚燃烧的化学方程式的书写.
点评:根据装置中各部分装置内所盛放的药品,推断该部分装置的作用,从而掌握整个装置的操作方法,这是正确解答问题需要最先解决的问题.

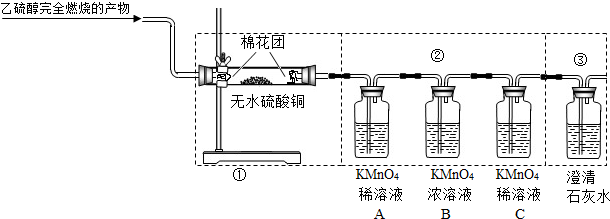
 的连接顺序改为②、①、③,则不能检出的物质是______.
的连接顺序改为②、①、③,则不能检出的物质是______. 2SO2↑+4CO2↑+6H2O.
2SO2↑+4CO2↑+6H2O. 2SO2↑+4CO2↑+6H2O.
2SO2↑+4CO2↑+6H2O.

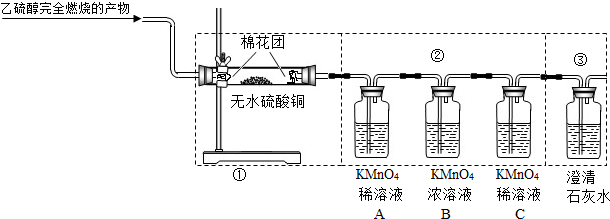
 的连接顺序改为②、①、③,则不能检出的物质是
的连接顺序改为②、①、③,则不能检出的物质是