
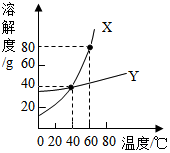
 X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)据图可以看出,40℃时,X、Y两种物质的溶解度相等,故填:相等;
(2)40℃时,X的溶解度是40g,故把30g的X加入50g水中,充分溶解,只能溶解20g,得到该温度下X的水溶液是饱和溶液,溶液的质量是70g,故填:饱和;70g;
(3)X的溶解度随温度的升高变化明显,故从X、Y的混合物中分离X物质,一般采用降温结晶的方法,故填:降温结晶.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


科目:初中化学 来源: 题型:计算题
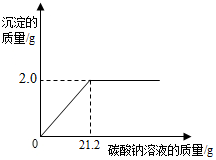 现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:
现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁制品在潮湿的空气中不易生锈 | |
| B. | “真金不怕火炼”说明黄金的熔点高 | |
| C. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| D. | 不锈钢的抗腐蚀性强于纯铁,硬度大于纯铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
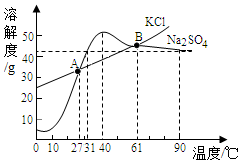 巳知氯化钾、硫酸钠的溶解度随温度变化时曲线如图所示.请回答以下问题:
巳知氯化钾、硫酸钠的溶解度随温度变化时曲线如图所示.请回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶于水后显碱性,所以它是一种碱 | |
| B. | 白醋的pH值小于7,所以它呈酸性 | |
| C. | 某物质在20℃时溶解度是30g,所以在20℃时,溶质为30g的该物质的溶液一定是饱和溶液 | |
| D. | 氧化物是指氧元素与另一种化学元素组成的化合物,所以含有氧元素的化合物都是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度(℃) | 产物 |
| 46.95 | MgCO3•3H2O |
| 47.95 | MgCO3•3H2O |
| 48.95 | MgCO3•3H2O |
| 49.95 | Mg5(OH)2(CO3)4•4H2O |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com