D
分析:A、根据所学的制氧气的原理,加热KClO
3制取氧气时加入催化剂反应的速率快;
B、根据已有的知识结合图象分析,酸性溶液的pH小于7,加入水,酸性减弱,pH变大,但不会大于7;
C、根据硫酸显酸性、氢氧化钾显碱性,二者恰好反应时溶液显中性进行分析;
D、根据恰好反应时消耗的硫酸钠溶液的质量和二者反应的方程式分析解答.氢氧化钠溶液呈碱性,加盐酸,酸与碱会中和,PH逐渐下降,盐酸过量,PH小于7,故D对.从而可以正确作答.
解答:
A、加热KClO
3制取氧气时加入催化剂反应的速率快,所以加入催化剂和不加入催化剂的反应不会同时开始反应,错误;
B、酸性溶液的pH小于7,加入水,酸性减弱,pH变大,但不会大于7,错误;
C、硫酸显酸性、氢氧化钾显碱性,二者恰好反应时溶液显中性,当硫酸溶液的质量为0时,溶液的pH=7,错误;.
D、观察图象可知,二者恰好反应时消耗的硫酸钠溶液的质量是7.10g,可根据方程式计算10.4g10%的BaCl
2溶液反应消耗的硫酸钠溶液的质量是否是7.1g,从而判断是否正确.
设参加反应的10%的硫酸钠溶液的质量是x.
BaCl
2 +Na
2SO
4 =BaSO
4↓+2NaCl
208 142
10.4g×10% x×10%
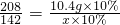
x=7.1g
所以D正确.
故选D.
点评:操作与图象对应的题,考查的知识点往往较多,综合性较强,因此,仔细审题,看清题目的细节至关重要.