
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
分析 A、镁燃烧生成氧化镁;
B、铁在氧气中燃烧生成四氧化三铁;
C、二氧化碳和氢氧化钙反应生成白色沉淀碳酸钙和水;
D、过氧化氢在二氧化锰的催化作用下分解生成水和氧气.
解答 解:A、镁燃烧的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,该选项书写不正确;
B、铁燃烧的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,该选项书写不正确;
C、二氧化碳和氢氧化钙反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,该选项书写不正确;
D、过氧化氢分解的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该选项书写正确.
故选:D.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
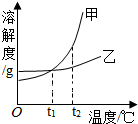
| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| C. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
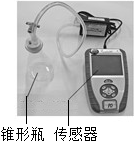 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.同学们通过如下实验来研究催化剂的某些因素对过氧化氢分解速率的影响.| 时间/s 压强/KPa 试剂 | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁粉末 | 102.21 | 105.35 | 115.40 | 129.69 | 145.62 | 163.99 |
| 加入氯化铜粉末 | 101.90 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④⑤①②③ | C. | ④②①⑤③ | D. | ②①③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| C. | 因为蜡烛燃烧生成C02和H2O,所以蜡烛组成里一定含有C和H | |
| D. | 因为碱溶液呈碱性,所以呈碱性的溶液一定都是碱溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
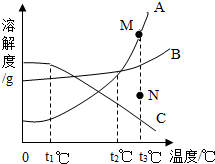 如图是A、B、C三种物质的溶解度曲线.下列叙述错误的是( )
如图是A、B、C三种物质的溶解度曲线.下列叙述错误的是( )| A. | 三种物质的溶解度大小顺序为A>B>C | |
| B. | t2℃时,A、B两种物质的饱和溶液溶质质量分数相等 | |
| C. | t3℃时B的饱和溶液降温到t1℃时仍为饱和溶液 | |
| D. | 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
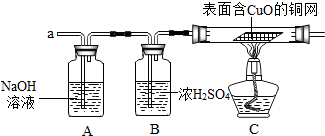
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不发生反应,收集不到氧气 | B. | 反应不完全,产生的氧气少 | ||
| C. | 能产生氧气,但反应速率慢,耗时长 | D. | 对反应毫无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com