
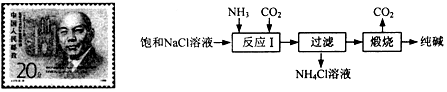
分析 (1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答;
(2)根据流程的原料和产物分析;
(3)根据物质的溶解度分析;碳酸氢钠加热生成碳酸钠、水和二氧化碳;
(4)根据碳酸钠与硫酸反应方程式和碳酸氢钠与硫酸反应方程式,列关系式求解.
解答 解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可过量CO2生成NaHCO3,溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;
(2)流程中二氧化碳可以直接循环使用;
(3)由于常温下,NaHCO3的溶解度小于Na2CO3,过量CO2生成NaHCO3更易于分离,碳酸氢钠加热生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑;
(4)设Na2CO3固体的质量为x,NaHCO3固体的质量为y
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x $\frac{44x}{106}$
2NaHCO3+H2SO4=Na2SO4+H2O+2CO2↑
168 88
y $\frac{88y}{168}$
可得:$\left\{\begin{array}{l}{\frac{44x}{106}+\frac{88y}{168}=4.62g}\\{x+y=11.02g}\end{array}\right.$
解得:x=10.6g,y=0.42g
样品中Na2CO3的质量分数为:$\frac{10.6g}{11.02g}×100%$≈96.2%,
答:样品中Na2CO3的质量分数为96.2%.
故答案为:(1)②;(2)CO2;(3)在该条件下,NaHCO3的溶解度小于Na2CO3;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑;
(4)96.2%.
点评 本题充分考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力、分析解决问题的能力,难度稍大.


 考前必练系列答案
考前必练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )
列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )| 氢氧化钠 | 碳酸钠 | |||
| 20℃ | 40℃ | 20℃ | 40℃ | |
| 水 | 109g | 129g | 21.8g | 49g |
| 酒精 | 17.3g | 40g | 不溶 | 不溶 |
| A. | 表格与图象均能反映温度对固体物质溶解度的影响,表格比图象更能直观体现变化规律 | |
| B. | 由表格数据可知,物质的溶解度只受温度影响 | |
| C. | 40℃时,将50gNaOH分别投入到100g水和酒精中都能得到饱和溶液 | |
| D. | 40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 29-A | 29-B |
| 用液氢和液氧作推进剂时,发生反应的化学方程式为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.若该火箭需要装入40t液氢,则需要同时装入液氧320t. | 用偏二甲肼(C2H8N2)和四氧化二氮 (N2O4)作推进剂.则N2O4中氮、氧元素的原子个数比为1:2;偏二甲肼中碳元素的质量分数为40%,其计算式为:$\frac{12×2}{12×2+1×8+14×2}×100%$. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com