
下面是硫酸密度和溶质的质量分数对照表
(20℃).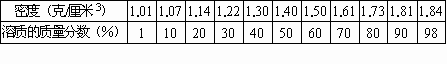
利用上表提供的硫酸密度计算下列各题:
(1)2升10%的硫酸溶液中含硫酸和水各多少克?
(2)若配制10%的稀硫酸60毫升,需98%的浓硫酸和水各多少毫升?
|
解: (1)2L=2000mL(即2000cm3)查表得知, 10%的硫酸密度为1.07g/cm32L10%稀硫酸中含硫酸的质量为: 1.07g/cm3×2000cm3×10%=214g 含水的质量为: 1.07g/cm3×2000cm3-214g=1926g 或 1.07g/cm3×2000cm3(1-10%)=1926g(2)设:需要98%的浓硫酸的体积为x 查表得知: 10%H2SO4的密度为1.07g/cm398%浓H2SO4的密度为1.84g/cm3 抓住加水稀释前后溶质质量不变列方程求解: 1.07g/cm3×60cm3×10%=1.84g/cm3·x·98% x=3.6cm3(即3.6mL) 需加水的体积为:
= 57.6cm3(即57.6mL)【过程探究】涉及溶液体积和溶质的质量分数的计算时,往往要借助于溶液的密度. 溶液的质量=溶液的密度 (ρ)×溶液的体积(V)溶液中溶质的质量=溶液的密度 (ρ)×溶液的体积(V)×溶液中溶质的质量分数(a%),即=ρ·V·a%.将浓溶液稀释,可加水稀释,也可加稀溶液稀释.但不管用水稀释还是用稀溶液稀释,解题的关键均是:抓住稀释前后溶质质量不变列方程.通常可利用下面两个公式计算: m浓·a%=(m浓+m水)·b% m浓·a%+m稀·b%=(m浓+m稀)·c% |
|
【设计意图】通过题目提供的信息,使学生认识到溶液的密度与溶液中溶质质量分数大小密切相关,对硫酸而言,溶液的密度随溶质质量分数增大而增大.通过本题考查学生利用密度进行有关溶液计算的能力;考查加水稀释的相关计算. |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
 下面是某研究性学习小组对氢氧化钠有关性质进行探究的过程,请回答下列问题.
下面是某研究性学习小组对氢氧化钠有关性质进行探究的过程,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:2011年河南省信阳市息县中考化学模拟试卷(二)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com