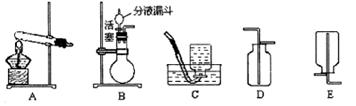
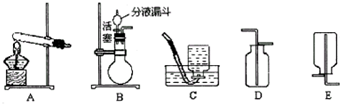
实验室常用如图装置制取气体,请你根据所学知识回答下列问题.
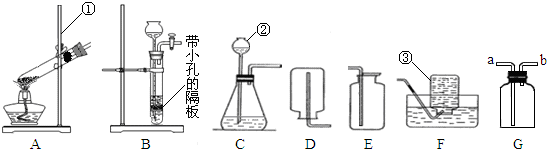
(1)写出编号所指仪器的名称:①
铁架台
铁架台
;②
长颈漏斗
长颈漏斗
;③
集气瓶
集气瓶
.
(2)A装置图中有两处明显的错误,请找出错误的地方并把改正的结果填在下列横线上:
①
试管口应该略向下倾斜
试管口应该略向下倾斜
;
②
用酒精灯的外焰加热
用酒精灯的外焰加热
.
上述装置改进后,请继续回答下列问题.
(3)在实验室中若选用C装置制取氧气,实验时发现此装置制取氧气的反应较为剧烈,为减缓反应速率,可以采取的措施是
将长颈漏斗换作分液漏斗,控制滴加液体的速度
将长颈漏斗换作分液漏斗,控制滴加液体的速度
.请写出用该装置制取氧气的反应文字表达式
.对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢溶液,采用不同质量的二氧化锰粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 二氧化锰粉末用量(g) |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
| 所用时间(t) |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
请你分析表中数据并回答:二氧化锰的用量对反应速率有无影响,如果有,怎样影响?
在一定范围内,二氧化锰的用量越大,反应越快,当二氧化锰的用量增加到一定的值后,继续增大二氧化锰的用量,反应速率不再增大
在一定范围内,二氧化锰的用量越大,反应越快,当二氧化锰的用量增加到一定的值后,继续增大二氧化锰的用量,反应速率不再增大
.
问题②:还有哪些因素可能影响该反应的速率?请写出你的一个猜想
二氧化锰颗粒大小
二氧化锰颗粒大小
.
(4)在实验室中若选用A装置制取氧气,请写出制取氧气的反应文字表达式
.若用装置E收集氧气,验满氧气的方法是
将带火星的木条放在集气瓶口,若木条复燃则说明氧气收集满了
将带火星的木条放在集气瓶口,若木条复燃则说明氧气收集满了
.若用装置F收集氧气,实验结束后发现收集到的氧气不纯,原因是
未等导管口出现连续均匀的气泡冒出时就收集气体
未等导管口出现连续均匀的气泡冒出时就收集气体
,实验结束后拆装置,要先
将导管从水槽中移出
将导管从水槽中移出
,后
熄灭酒精灯
熄灭酒精灯
,这样做的理由是
为了防止水槽中的水倒吸入试管中
为了防止水槽中的水倒吸入试管中
.
(5)装置B、C都可以用来制取二氧化碳,比较这两个装置的不同,指出B装置的一个突出优点
可以随时控制反应的开始或停止
可以随时控制反应的开始或停止
,请写出实验室制取二氧化碳的反应文字表达式
碳酸钙+盐酸→氯化钙+水+二氧化碳
碳酸钙+盐酸→氯化钙+水+二氧化碳
.
(6)硫化氢是一种有毒气体,密度比空气大,能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢气体.实验室制取硫化氢气体应选用的发生装置是
B或C
B或C
,若收集装置选用G,则硫化氢气体应从
a
a
(填“a”或“b”)导管进入集气瓶中.



 阶梯计算系列答案
阶梯计算系列答案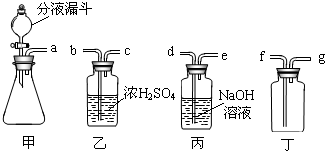
 检验时所发生反应的化学方程式.
检验时所发生反应的化学方程式.
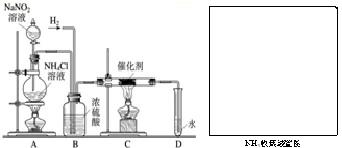 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):