
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该固体于试管中,加水溶解,向溶液中滴加过量氯化钡溶液,并不断振荡. | 有白色沉淀产生. | 说明原固体中一定含有 |
| (2)取(1)试管中的上层清液,滴加酚酞试液. | 溶液变红色. | 说明原固体中一定含有 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该固体于试管中,加水溶解,向溶液中滴加过量氯化钡溶液,并不断振荡. | 有白色沉淀产生. | 说明原固体中一定含有 Na2CO3. |
| (2)取(1)试管中的上层清液,滴加酚酞试液. | 溶液变红色. | 说明原固体中一定含有 NaOH. |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.查阅相关的资料:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的四种溶液的pH大小情况见表格
在实验室里,我们常用大理石和盐酸反应制取二氧化碳.某大理石主要成分为CaCO3,还有少量的硫化物.查阅相关的资料:已知碳酸钙与盐酸的复分解反应可自发进行.在常温下,测得浓度均为a%的四种溶液的pH大小情况见表格| 溶质 | H2SO4 | HCl | H2S | H2CO3 |
| pH | 小→大 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:
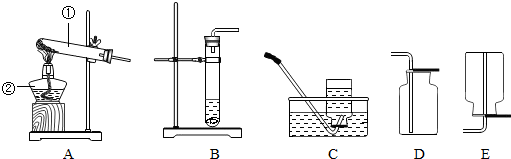
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
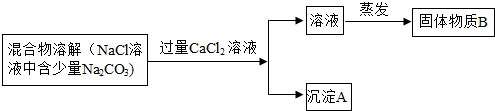
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com