
| A. | 玻璃破碎 | B. | 氢气+氧气$\stackrel{点燃}{→}$水 | ||
| C. | 过氧化氢$\stackrel{催化剂}{→}$ 水+氧气 | D. | 食盐水$\stackrel{蒸发}{→}$水+食盐 |
科目:初中化学 来源: 题型:解答题
 空气中氧气体积含量的测定
空气中氧气体积含量的测定查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ①α-丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示,(注:“
①α-丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示,(注:“ ”表示氮原子;“
”表示氮原子;“ ”表示碳原子;“
”表示碳原子;“ ”表示氧原子;“
”表示氧原子;“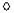 ”表示氢原子,“-”表示原子之间相互连接.),则α-丙氨酸的化学式是C3H7O2N,其相对分子质量是89;碳、氢、氧、氮4种元素质量比是36:7:32:14,氮元素的质量分数是15.7%.
”表示氢原子,“-”表示原子之间相互连接.),则α-丙氨酸的化学式是C3H7O2N,其相对分子质量是89;碳、氢、氧、氮4种元素质量比是36:7:32:14,氮元素的质量分数是15.7%.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 据如图回答问题:
据如图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室里有一瓶标签残缺的盐酸,请你探究.
实验室里有一瓶标签残缺的盐酸,请你探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com