
【题目】(题文)(题文)根据铝与硫酸铜溶液反应的示意图,请用化学用语表示下列带点文字部分:
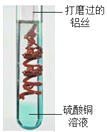
(1)铝丝进行打磨的目的是除去其表面的氧化铝簿膜_______;
(2)硫酸铜溶液显蓝色,是因为溶液中含有铜离子____________;
(3)图中发生反应的化学方程式______________。
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:初中化学 来源: 题型:
【题目】根据下图判断,下列说法错误的是( )
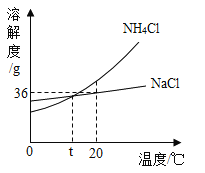
A. NaCl和NH4Cl的溶解度都随温度升高而增大
B. 将20℃时某NH4Cl溶液降温到0℃,其溶质质量分数一定减小
C. 20℃时,20gNaCl加入到50g水中,搅拌后不能全部溶解
D. t℃时,NH4Cl饱和溶液和NaCl饱和溶液溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在硫酸与硫酸铜的混合溶液200g中,滴入40%的NaOH溶液100g,恰好完全反应,记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.

回答:
(1)与硫酸铜反应的氢氧化钠溶液的质量为__________g。
(2)此硫酸的溶质质量分数为________?
(3)反应后溶液溶质的质量分数是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的FeO、CuO。工艺流程图如下:(假设每一步骤反应均完全)

⑴为提高矿石的溶解速度,操作1是___________ 。
⑵菱锌矿溶解后所得的溶液中金属阳离子有_____________种。
⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,写出反应1中生成Fe2(SO4)3的化学方程式___________________________。
⑷结晶之前,溶液中除了硫酸锌,还一定存在的溶质是_________________。
⑸硫酸锌晶体的溶解度曲线如下图所示,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为____________________。

⑹流程中还可能得到一种紫罗兰色晶体(NH4)xFey(SO4)z·7H2O。已知该化合物中氮、铁元素质量比为1:4,则x:y :z=________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用和相应的化学方程式都正确的是
A. 高炉炼铁发生的主要反应:2Fe2O3+3C高温4Fe+3CO2↑
B. 用生石灰处理硫酸厂废液:Ca(OH)2+H2SO4=CaSO4+2H2O
C. 用硝酸银溶液鉴别海水和蒸馏水:AgNO3+NaCl=AgCl↓+NaNO3
D. 用稀盐酸鉴别黄铜和黄金:Cu + 2HCl = CuCl 2 + H2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】MnO2是一种既不溶于水也不溶于稀硫酸的重要无机功能材料,粗MnO2(含有较多的MnO和MnCO3)的提纯是工业生产的重要环节。下图是某研究性学习小组在实验室中模拟工业上粗MnO2转化为纯MnO2的工艺流程。

请回答下列问题:
(1)操作A的名称是_____;蒸发操作中玻璃棒的作用是____;
(2)NaClO3中氯元素的化合价为____________价;
(3)写出粗MnO2样品加稀H2SO4时产生CO2的化学方程式________;
(4)该流程中可以循环利用的物质是H2SO4和________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题.
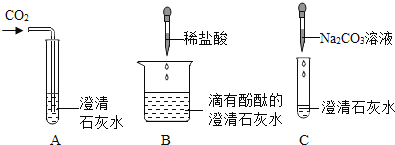
(1)实验A中,一定能够观察到的明显现象是________;
(2)实验B验证了氢氧化钙能跟酸、_______作用;
(3)实验C中发生的反应可用化学方程式表示为_______________;
(4)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家发现,通过简单的化学反应,可以将树木的纤维素变成超级储能装置,下图是该反应的微观示意图,下列说法正确的是________
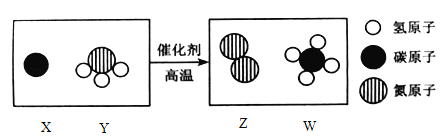
A.W物质中碳元素的质量分数为50%
B.化学反应前后原子的种类、个数、质量均保持不变
C.上图中涉及的化合物有3种
D.参加该反应中Z与W的分子个数比为__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CaCO3在生产生活中有广泛的用途.
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________。为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
Ⅰ.取石灰石样品分为三等份,在同一设备中分别于800℃、900 ℃和1000℃条件下煅烧;
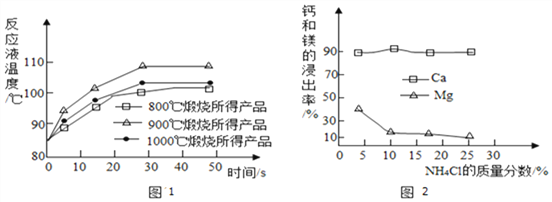
Ⅱ.所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。上述温度中,___________℃时煅烧所得CaO活性最高。
(2)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯活性CaCO3的流程如图3。(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
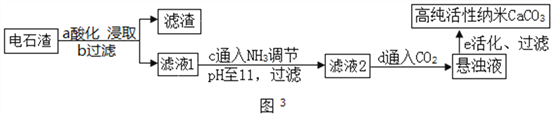
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液呈________性(填酸性、中性或碱性);如图2为浓度对钙、镁元素浸出率的影响。由图可知NH4Cl溶液的质量分数达到10%以上主要溶解的是Ca(OH)2;浸取时主要发生反应的化学方程式为_________________。
②流程c通入NH3的目的主要有两个,一是调节溶液的pH值,二是_______。
③滤液1中通入NH3和CO2后生成碳酸钙和氯化铵,写出发生反应的化学方程式为________________。
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程中可循环利用的物质有__________________(写出两种物质)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com