
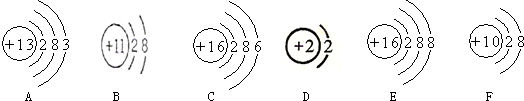
分析 (1)若粒子的最外层电子数为8,(氦为2个)属于相对稳定结构;
(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,据此进行分析解答.
(3)最外层电子数小于4的原子易失去电子;
(4)根据质子数与电子数的特点分析回答;
(5)根据稀有气体元素的种类分析;
(6)根据B、E粒子的特点分析;
(7)根据最外层电子数主要决定元素的性质分析.
解答 解:(1)BCF的最外层电子数均为8,D的最外层也是第一层有2个电子,均具有相对稳定结构;
(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,EF的质子数相同,属于同种元素.
(3)A的最外层电子数是1,在化学反应中易失去电子;
(4)在B中,质子数是11,电子数10.是钠离子属于阳离子,符号是Na+;在E中,质子数是16,电子数是18,是硫离子,属于阴离子,符号是:S2-.
(5)图中F质子数=核外电子数=10,为稀有气体原子.
(6)B是钠离子、E粒子是硫离子,形成的化合物为硫化钠,化学式为Na2S;
(7)图中DF到达了稳定结构,化学性质相似.
故答案为:(1)BCDF;B;(2)EF.(3)A(4)Na+,S2-;(5)F;(6)Na2S;(7)DF.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素和三氧化二砷都属于氧化物 | |
| B. | 青蒿素和三氧化二砷都是由分子构成 | |
| C. | 碳、氢、氧原子保持青蒿素的化学性质 | |
| D. | 三氧化二砷中含有臭氧(O3)分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧产生大量白雾 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 电解水实验中,正极产生的气体体积是负极的2倍 | |
| D. | 碳在空气中燃烧生成二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
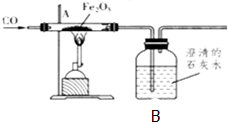 如图为研究冶炼铁的化学原理的装置,指出A、B处出现的现象,并写出化学反应方程式:
如图为研究冶炼铁的化学原理的装置,指出A、B处出现的现象,并写出化学反应方程式:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | c=a+b | B. | c=2b-a | C. | c=a+2 b | D. | c=2 a-b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com