
| 选项 | 物质 | 杂质 | 试剂 |
| A | CO2 | SO2 | NaOH溶液 |
| B | KCl | K2SO4 | Ba(OH)2溶液 |
| C | CO2 | CO | Ca(OH)2溶液 |
| D | CaCO3 | CuSO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、CO2和SO2均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.
B、K2SO4能与Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化钾,能除去杂质但引入了新的杂质氢氧化钾,不符合除杂原则,故选项所采取的试剂错误.
C、CO2能与Ca(OH)2溶液反应生成碳酸钙沉淀和水,CO不与Ca(OH)2溶液反应,反而会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.
D、CuSO4易溶于水,CaCO3难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的试剂正确.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | Cu (Fe ):加入过量的稀盐酸、过滤、洗涤、干燥 | |
| B. | CO2( CO):将气体点燃 | |
| C. | KNO3( NaCl):加水溶解、蒸发溶剂 | |
| D. | CaO (CaCO3 ):加足量的水、过滤、干燥 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C均为初中化学常见纯净物,它们之间的转化关系如图所示(图中“→”表示物质间存
A、B、C均为初中化学常见纯净物,它们之间的转化关系如图所示(图中“→”表示物质间存查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题:
某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 5.5g | B. | 5g | C. | 4.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
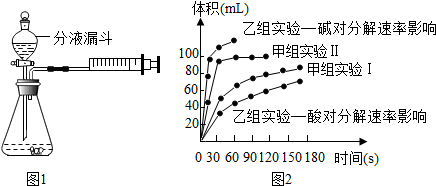
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对过氧化氢分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%过氧化氢 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%过氧化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com