
| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| 1 | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |
 已知第4次实验中Zn与H2SO4恰好完全反应.
已知第4次实验中Zn与H2SO4恰好完全反应.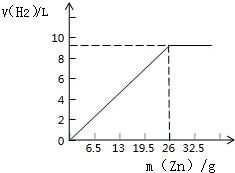
| 65 |
| 26g |
| 98 |
| x |
| 39.2g |
| 200g |
| 9.2L |
| 2.3L |


科目:初中化学 来源: 题型:
 (2002?重庆)用锌与硫酸溶液反应,五次实验结果记录如下:
(2002?重庆)用锌与硫酸溶液反应,五次实验结果记录如下:| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| l | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 产生氢气质量 |
| 1 | 6.5 | 200 | 0.2 |
| 2 | 13.0 | 200 | 0.4 |
| 3 | 19.5 | 200 | 0.6 |
| 4 | 26.0 | 200 | 0.8 |
| 5 | 32.5 | 200 | 0.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 用锌与硫酸溶液反应,五次实验结果记录如下:
用锌与硫酸溶液反应,五次实验结果记录如下:| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| 1 | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |
查看答案和解析>>
科目:初中化学 来源:2006年浙江省杭州市中考科学模拟试卷(化学部分)(解析版) 题型:解答题
| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| 1 | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com