
【题目】下表是 NaHCO3和NH4Cl在不同温度下的溶解度。下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度/g | NaHCO3 | 10.0 | 11.0 | 13.0 | 14.0 |
NH4Cl | 35.0 | 39.0 | 43.0 | 48.0 | |
A.20℃时,配制等质量的 NaHCO3和NH4Cl饱和溶液,NH4Cl需要水少
B.饱和氨盐水吸收CO2后生成的 NaHCO3和NH4Cl,NaHCO3先结晶析出
C.20℃时,NaHCO3饱和溶液的溶质质量分数为10%
D.50℃时,148g NH4Cl饱和溶液降温到20℃,析出13 g NH4Cl晶体
【答案】C
【解析】
根据溶解度的含义,固体物质溶解度是指一定温度下,物质在100g水中达到饱和状态时所溶解的质量,所谓饱和状态是一定温度下、一定量的溶剂中,指物质所能溶解的最大量。
A.20℃时,配制等质量的 NaHCO3和NH4Cl饱和溶液,NH4Cl需要水少,NaHCO3需要水多,因为在该温度下NH4Cl的溶解度大于 NaHCO3的溶解度;故此选项正确;
B.根据图表可知,四种不同温度下,NaHCO3的溶解度均比NH4Cl最小,所以NaHCO3先结晶析出,故此选项正确;
C.20℃时,NaHCO3的溶解度为10g,所以NaHCO3饱和溶液的溶质质量分数为![]() ,故此选项错误;
,故此选项错误;
D.50℃时,148g NH4Cl饱和溶液中含有溶质48g,溶剂100g;降温到20℃,溶解度是35g,即100g水中最多溶解溶质35g,所以析出晶体NH4Cl的质量是48g-35g=13g,故此选项正确。


科目:初中化学 来源: 题型:
【题目】人体胃液中含有的酸是_______________。右图是沾有污渍的某抗酸的部分说明,同学们对此展开了系列研究。

Ⅰ.服用方法探究:为什么嚼碎后服用?你认为需后服用的自的是____________。
Ⅱ.抗酸原理探究:
(1)含有NaHCO3相Al(OH)3的药片都能用于治疗胃酸过多,反应原理用方程式可表示为(任写一个)_______________。
(2)查阅资料可知铝碳酸镁是层状结构(如图),则铝碳酸镁中起到抗酸作用的微粒的符号有____。
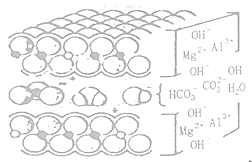
Ⅲ.主成分探究:
(查阅资料)铝碳酸镁片加感分解的产物为Al2O3、MgO、CO2和H2O,药品中的其它成分受不分解。
(实验过程)学习小设计了如下图的实验探究铝碳酸镁片的组成。

(1)检查装置气密性,取8.6g该药片,研成粉末放入硬质玻璃管中;
(2)实验开始前先通入一定量空气,然后称量装置D的质量;
(3)点燃消精灯加热。充分反应后,停让加热;
(4)通入空气至玻璃管冷却,目的是防止液体倒吸和___________,然后测得装置D增重0.44g。
(实验结论)铝碳酸镁的化学式为____________。药片中铝碳酸镁的质量分数是________。
(拓展延伸)有医生生建议患有严重胃胀、胃溃疡的患者最好慎用该药而改服氢氧化铝片,试用你学的知识解释这样建议的理由是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请按照要求完成下列金属性质的探究:
探究一:铝片与盐酸反应过程中的能量及反应速率的变化。
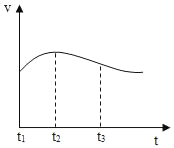
(1)实验时需将铝片进行打磨,其目的是_____。
(2)反应中试管外壁发烫,说明铝与盐酸反应是_____(填“吸热”或“放热”)反应,化学方程式为_____。
(3)实验测得铝片产生气体的速率(v)与时间(t)的关系如图所示,t1~t2时间内反应逐渐加快的主要原因是_____。
(查阅资料)铁、铜均能与氯化铁溶液反应,化学方程式分别为:2FeC13+Fe═3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2
(4)向氯化铁和氯化铜的混合溶液中,加入一定量的铁粉,充分反应后过滤。取少量滤渣加入稀盐酸,有气泡产生。则滤液中的溶质是_____,滤渣中一定含有_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验活动课上,同学们利用了如图所示实验探究氢氧化钙的性质。
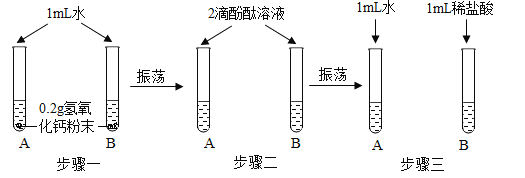
(1)上述三个步骤的A试管中固体始终无明显减少,那么能说明A试管的水中溶有氢氧化钙的现象是__________。
(2)步骤三试管B中溶液变无色,发生反应的化学方程式_______________。
小明的实验:小明直接把稀盐酸滴入盛有氢氧化钙溶液的试管中,始终没有看到明显变化。
(提出问题)小明实验后试管中溶质的成分是什么?
(查阅资料)CaCl2溶液显中性。
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想I:只有CaCl2猜想Ⅱ有________
猜想Ⅲ:有CaCl2和Ca(OH)2
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_____________
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3 |
实验操作 |
|
|
|
实验现象 | _________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )
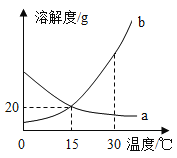
A.15℃时,a、b 的溶解度均为20g
B.加水或升温均可使b的饱和溶液变为不饱和溶液
C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D.分别向100g 水中加入20ga和 b,升温至30℃,所得溶液均 为饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是从海水中提纯精盐的流程:
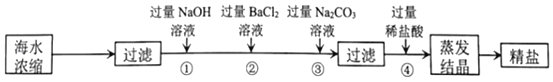
(除NaCl外,还有泥沙、MgCl2、CaCl2、Na2SO4)
(1)加入过量Na2CO3溶液的目的是除去CaCl2和_____,流程中不能用过量稀硫酸代替过量稀盐酸的原因是_____。
(2)写出④中发生反应的化学方程式:_____(写出其中一个即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。下列叙述错误的是( )
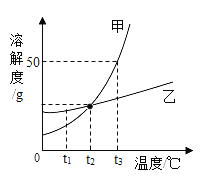
A.t2℃时,甲、乙两种固体物质的饱和溶液中溶质的质量分数相等
B.加入乙物质或蒸发溶剂能使乙的不饱和溶液变成饱和溶液
C.相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃,析出固体的质量甲<乙
D.t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示为实验室中常见的气体制备、净化、干燥、收集和性质实验的部分仪器,

(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各探究实验。
(1)小颖同学以过氧化氢溶液和二氧化锰为原料,欲在实验室中制备并收集干燥的氧气。 她按照要求设计实验装置、连接仪器,并检验了装置的气密性。
①她所选仪器的连接顺序应为___________(从左至右填写仪器序号字母)。
②用过氧化氢溶液和二氧化锰制取氧气的化学方程式为___________。
(2)小梅同学选择并连接了装置 A→G→H 进行某气体性质的探究实验。实验过程中,她观察到装置 G 中的溶液变白色浑浊,装置 H 中的低处蜡烛先熄灭,高处蜡烛后熄灭。
①小梅同学在装置 A 中加入的药品组合应为___________(填序号)。
A 生石灰和稀盐酸 B 熟石灰和稀盐酸 C 石灰石和稀盐酸 D 锌粒和稀硫酸
②装置 A 中发生反应的化学方程式为___________。
③根据上述实验信息,下列有关该气体性质的说法中,错误的是___________(填序号)。
A 该气体能与氢氧化钙溶液反应生成白色沉淀 B 通常状况下,该气体密度大于空气
C 该气体不可燃,且不支持燃烧 D 通常状况下,该气体密度小于空气
(3)小路同学想对某种塑料样品的组成元素进行探究实验(资料显示该塑料一定含 C、H 元素,可能含氧元素),她选择了部分仪器装置,并按“A→C1→B→C2→D→碱石灰干燥管”的顺序连接。
(已知:装置 A 中试剂为 H2O2 溶液和 MnO2 ,装置 C1、C2 为盛有浓硫酸的洗气瓶)。她在实验前检验了装置气密性,然后使一定量的该塑料样品碎屑在纯氧气中充分燃烧,观察现象并准确收集了该实验的有关数据。(假设所有发生的化学反应都充分进行)
①已知装置 B 的大玻璃管内放入了 6.0g 塑料试样碎屑,塑料试样充分燃烧后,测得装置 C2 的 质量增加了 3.6g,装置 D 的质量增加了 8.8g,则该塑料试样的元素组成为___________。
②装置 C1 的作用是___________。
③若上述实验中不连接装置 C1,这将会对塑料样品组成元素的实验测定结果产生怎样的影响___________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】关于下列五种粒子结构示意图的说法中正确的是( )
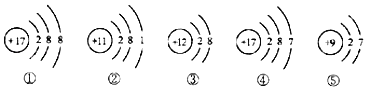
A. ①④属于不同种元素
B. ②⑤属于金属元素
C. ④⑤均具有稳定结构
D. ①③两种粒子可以形成化合物MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com