
根据图所示的市售浓硫酸的标签计算:已知该浓硫酸的溶质质量分数为
98%,现要配制10%的稀硫酸2 940g作为钢铁表面的清洗剂(酸洗液),需要浓硫酸___________g,换算成体积约为___________mL,还需要水(密度约为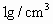 )__________mL(计算结果保留整数).
)__________mL(计算结果保留整数).

科目:初中化学 来源: 题型:
 实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:
实验室中,用98%的浓硫酸稀释成100g 20%的稀硫酸.根据如图所示的市售浓硫酸的标签,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com