


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:阅读理解
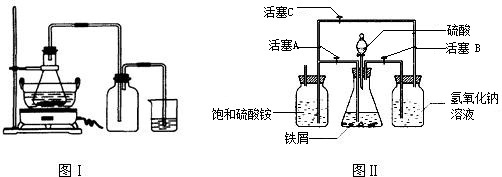
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
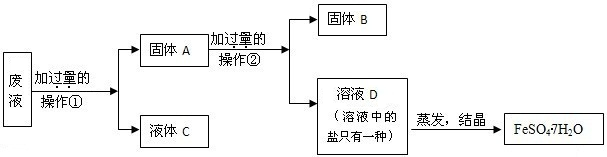
 (2005?绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为
(2005?绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 化学用语是学习化学的重要工具.
化学用语是学习化学的重要工具.| +2 |
| Mg |
| +2 |
| Mg |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省徐州三十四中九年级(上)期中化学模拟试卷(解析版) 题型:填空题

查看答案和解析>>
科目:初中化学 来源:2010年山东省中考化学全真模拟试卷(五)(解析版) 题型:解答题
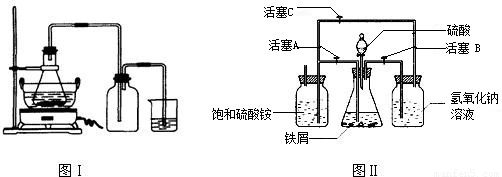
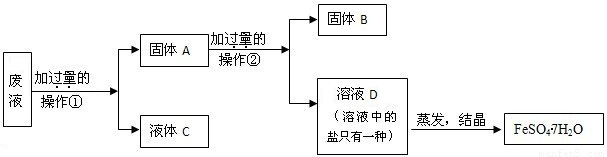
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com