
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
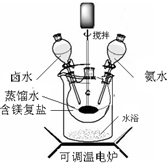 碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银或AgNO3 硝酸银或AgNO3 溶液 |
现象① 产生气泡 产生气泡 ;现象② 产生白色沉淀 产生白色沉淀 ; |
含有 Cl- |
| ||
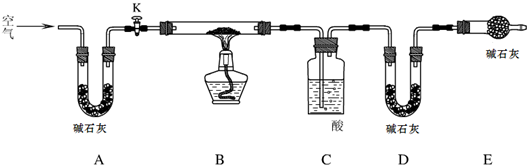
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl Na2CO3+CaCl2═CaCO3↓+2NaCl |
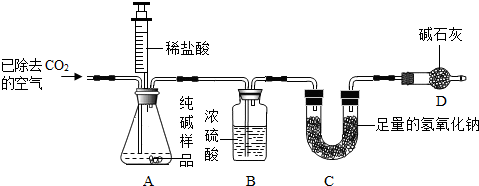
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源:江苏模拟题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com