解:(1)从实验安全和实验操作程序看,实验开始先加热A处,防止发生爆炸,实验结束时,应先停止加热氧化铁;一氧化碳有毒,过程中可能一氧化碳过多,必须对尾气进行处理,可采取用气球收集或点燃的方法.
(2)B装置内是氢氧化钠能吸收产生的二氧化碳,E装置则是吸收并检验二氧化碳的存在,D装置中反应的化学方程式为:3CO+Fe
2O
3
3CO
2+2Fe;
(3)原有样品为氧化铁(10g),玻璃管的质量为50g,故反应后为剩余固体为(7.6g),减少的质量为2.4g,实质就是氧元素的质量,运用差量法解题
设氧化铁的质量为X
3CO+Fe
2O
3
3CO
2+2Fe△m
160 112 48
X (10-7.6)g
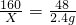
X=8g
氧化铁的质量分数为:
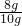
×100%=80%
(4)E装置在反应后增加的质量是反应中生成的二氧化碳的质量,如果B装置吸收CO
2不充分或E吸收了装置里空气中的CO
2或者外界CO
2进入的干扰,就会使二氧化碳的质量增大,实际测定结果就会偏大:
故答案为:(1)A;先;气球收集或点燃;
(2)吸收A中反应生成的二氧化碳;检验D中反应生成的二氧化碳;3CO+Fe
2O
3
3CO
2+2Fe;
(3)80%;
(4)B装置吸收CO
2不充分;E吸收了装置里空气中的CO
2或者外界CO
2进入的干扰(给出一条合理答案即可).
分析:本题是在原有一氧化碳还原氧化铁的实验基础上增加了制取纯净的一氧化碳的实验,由题中信息,草酸分解后得到的一氧化碳中混有二氧化碳和水蒸气,因此要预先除掉二氧化碳.氢氧化钠与二氧化碳反应消耗二氧化碳,浓硫酸具有吸水性除去水分.产生的二氧化碳使澄清石灰水变浑浊,过程中可能一氧化碳过多,必须对尾气进行处理.(3)中氧化铁还原为铁,质量减轻,运用差量法可求出氧化铁的质量,再利用质量分数公式求算.
点评:本题考查了一氧化碳还原氧化铁的反应原理、步骤、实验现象、尾气处理以及应用.要注意有毒气体不能随意排放,必须经过处理后变成无害物质再排放.


 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O 3CO2+2Fe;
3CO2+2Fe; 3CO2+2Fe△m
3CO2+2Fe△m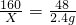
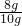 ×100%=80%
×100%=80% 3CO2+2Fe;
3CO2+2Fe;

 某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
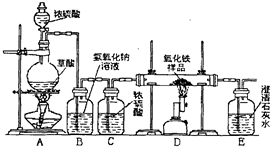 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应: