
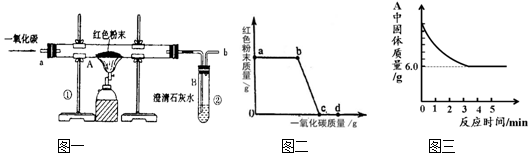
分析 (1)根据反应物、生成物和反应条件书写方程式;
(2)实验开始先通入一氧化碳,排尽试管内空气,防止加热发生爆炸,反应完成要继续通一氧化碳,防止生成的铁被氧化,此两步一氧化碳都未发生反应,a-b红色粉末的质量未变,说明反应尚未开始;
(3)一氧化碳有毒,未发生反应的一氧化碳要进行处理;
(4)工业炼制的是生铁,此处炼制的是纯铁;
(5)根据图示用差量法可以计算.根据一氧化碳只与氧化铁反应,根据提供的数据计算出氧化铁的质量,然后计算出样品中铁粉的质量分数;
(2)根据(1)的计算结果可知氧化铁的质量,可计算出7.2g固体样品中铁的质量,然后再加上4g氧化铁中铁的质量,即得铁元素总质量;再根据化学式中元素的质量分数,计算出氧化铁中氧元素的质量,然后求二者的比值.
解答 解:(1)红色粉末是氧化铁,氧化铁和一氧化碳在高温条件下生成铁和二氧化碳,方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)实验开始先通入一氧化碳,排尽试管内空气,防止加热发生爆炸,反应完成要继续通一氧化碳,防止生成的铁被氧化,此两步一氧化碳都未发生反应,所以不能根据通入一氧化碳的质量 进行计算,a-b红色粉末的质量未变,说明反应尚未开始;
故选①⑤;
(3)一氧化碳有毒,未发生反应的一氧化碳要进行处理,图中缺乏尾气处理装置;
故答案为:没有对尾气进行处理;
(4)工业炼制的是生铁,含有一定量的碳,此处炼制的是纯铁,二者一个是纯净物,一个是混合物;
故答案为:该实验炼制的铁是纯净物,工业炼制的生铁是混合物,含有一定量的碳;
(5)一氧化碳与氧化铁反应生成铁和二氧化碳,所以玻璃管固体减少的质量是氧化铁中氧元素的质量.
解:设氧化铁的质量为x.
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 固体减少的质量
160 112 160-112=48
x 7.2g-6g
$\frac{160}{x}=\frac{48}{7.2g-6g}$
x=4g
所以样品中铁粉的质量是7.2g-4g=3.2g
样品中Fe元素总质量:3.2g+4g×$\frac{112}{160}$×100%=6g
O元素总质量:4g×$\frac{16×3}{160}$×100%=1.2g
所以样品中铁元素与氧元素的质量比是:6g:1.2g=5:1
答:该样品中铁元素与氧元素的质量比是5:1.
故填:5:1.
点评 本题对一氧化碳还原氧化铁进行了综合的考查,既包括方程式、实验步骤、装置等知识的考查,又考查了相关计算,有一定的难度.


科目:初中化学 来源: 题型:选择题
| A. | 无机盐 | B. | 脂肪 | C. | 蛋白质 | D. | 糖类 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 滴入适量 AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量 FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 滴入几滴酚酞试液,酚酞试液不变色 | |
| D. | 测得反应后溶液中 Na+与 Cl-的个数比为 1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 物质a中混有少量b物质,应采用冷却热饱和溶液的方法进行提纯 | |
| B. | 在温度高于80℃时,a物质的溶解度大于b物质的溶解度 | |
| C. | 在37℃时,将20克a物质放入50克水中,充分溶解后得到的溶液,其溶质质量分数为23.1% | |
| D. | 分别将a、b两物质的饱和溶液从60℃降至37℃,析出晶体(不含结晶水)较多的是a |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ①水在天然循环过程中实现了水的自身净化
①水在天然循环过程中实现了水的自身净化查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
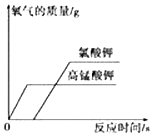 对资料或实验证据的分析是否正确,直接关系到科 学探究是否符合客观事实.下图为实验室用等质量的 高锰酸钾和氯酸钾(另加少量的二氧化锰)分别制取氧 气的数据分析示意图.下列依据下图所得出的结论正 确的是( )
对资料或实验证据的分析是否正确,直接关系到科 学探究是否符合客观事实.下图为实验室用等质量的 高锰酸钾和氯酸钾(另加少量的二氧化锰)分别制取氧 气的数据分析示意图.下列依据下图所得出的结论正 确的是( )| A. | 同时开始加热,先收集到氧气的是氯酸钾 | |
| B. | 用相同容积的试管制取较多量的氧气时,宜选择氯酸 钾为原料 | |
| C. | 加入少量的二氧化锰使氯酸钾产生的氧气质量增加 | |
| D. | 反应时间较长的是高锰酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com