
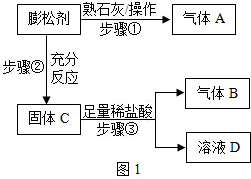
 网友曝出某食品加工厂竟然将碳酸氢铵当做膨松剂加入面粉中制作饼干.某化学研究小组同学对此产生了疑问,并进行了科学探究活动.
网友曝出某食品加工厂竟然将碳酸氢铵当做膨松剂加入面粉中制作饼干.某化学研究小组同学对此产生了疑问,并进行了科学探究活动.
| ||
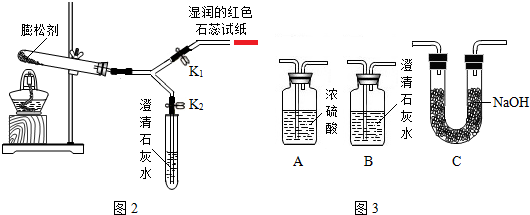
| 实验序号 | 实验操作 | 最终数据记录 |
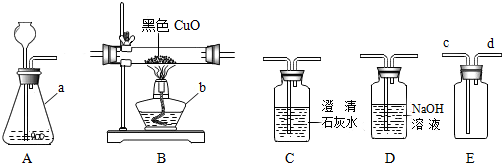
| 实验1 | 关闭K2,打开K1,橡皮管连接AC,加热试管 | 装置C增重13.2g |
| 实验2 | 关闭K1,打开K2,橡皮管连接 | 装置A增重1.7g |
| ||
| ||
| ||
| ||
| 18 |
| 44 |
| x |
| 8.8g |
| 17 |
| 18 |
| 1.7g |
| y |


科目:初中化学 来源: 题型:
| A、HCl、Na2CO3、NaOH、KNO3 |
| B、CuSO4、NaOH、BaCl2、HNO3 |
| C、CaCl2、K2CO3、Mg(NO3)2、NaCl |
| D、CuSO4、Ba(OH)2、KNO3、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
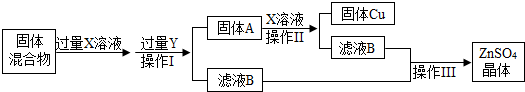
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 在实验室里,某同学看到氢氧化钠试剂瓶的瓶口有白色粉末,如图所示:
在实验室里,某同学看到氢氧化钠试剂瓶的瓶口有白色粉末,如图所示: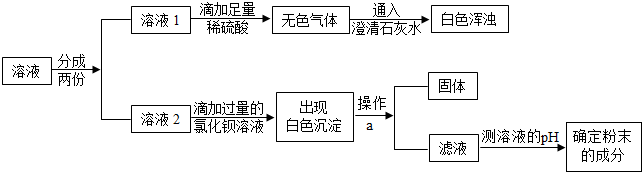
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com