
| 反应前 | 反应后 | |
| 烧杯及其中物质的质量 | 97.0g | 96.8g |
分析 (1)根据铁与硫酸反应放出氢气的特点,根据质量守恒定律,可判断反应前后质量差为恰好完全反应时所产生的氢气质量;根据反应的化学方程式,由恰好完全反应时生成氢气的质量计算所消耗铁的质量;铁的质量与样品的质量比可计算生铁样品的质量分数;
(2)恰好完全反应后所得溶液为硫酸化亚铁溶液,根据反应的化学方程式,由氢气质量计算出生成的硫酸亚铁的质量,利用质量守恒定律计算出恰好完全反应后所得溶液质量,然后利用溶液中溶质质量分数计算公式求出反应后所得溶液中溶质的质量分数.
解答 解:(1)根据质量守恒定律,反应生成的氢气质量=97.0g-96.8g=0.2g;
设生铁中铁的质量为x,生成硫酸亚铁质量为y,则
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
$\frac{56}{x}=\frac{152}{y}=\frac{2}{0.2g}$
x=5.6g,y=15.2g
生铁样品中铁的质量分数=$\frac{5.6g}{6.0g}$×100%=93.3%
(2)反应后所得溶液中溶质的质量分=$\frac{15.2g}{65.0g+5.6g-0.2g}$×100%≈21.6%
答:(1)生铁中铁的质量分数为93.3%,
(2)反应所得溶液中FeSO4的质量分数约为21.6%.
点评 根据质量守恒定律,反应后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 玻璃棒 | C. | 漏斗 | D. | 胶头滴管 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/克 | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/克 | 7.1 | 6.2 | 5.3 | 5.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 26.5% | B. | 28.6% | C. | 40% | D. | 30% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 探究铁制品在什么条件下容易生锈 | B. | 鉴别纯碱和食盐 | ||
| C. | 检验味精中氯化钠的含量 | D. | 比较食盐、蔗糖在水中的溶解能力 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 油锅起火--用锅盖盖灭 | B. | 酒精灯着火-用湿抹布盖灭 | ||
| C. | 森林起火--砍伐树木形成隔离带 | D. | 汽车油箱着火-用水浇灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
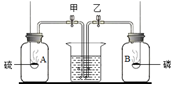 如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )
如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )| A. | A瓶中有水流入 | B. | A、B瓶中均无水流入 | ||
| C. | A、B瓶中均有水流入 | D. | B瓶中有水流入 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com