如表是硫酸溶液和氨水的密度与其溶质质量分数对照表(20℃).
| 溶液中溶质的质量分数 |
4% |
12% |
16% |
24% |
28% |
| 硫酸溶液的密度/g?mL-1 |
1.02 |
1.08 |
1.11 |
1.17 |
1.20 |
| 氨水的密度/g?mL-1 |
0.98 |
0.95 |
0.94 |
0.91 |
0.90 |
请你仔细分析后回答下列问题:
(1)根据表可总结出的规律是:对于硫酸溶液
;对于氨水
.
(2)某同学多次、随机抽取表中数据来探究浓、稀溶液等体积混合后,溶质质量分数与浓、稀溶液等质量混合后溶质质量分数之间的关系.
已知:将12%的硫酸溶液与28%的硫酸溶液等质量混合,所的溶液中溶质的质量分数等于a%,此a值为
.而将12%的硫酸溶液与28%的硫酸溶液等体积混合,所得溶液中溶质的质量分数
a%(用“>”、“<”或“=”填空,下同);将12%的氨水与28%的氨水等体积混合,所得溶液中溶质的质量分数
a%.
(3)根据以上计算或推理的结果,总结出的规律是:a.
;b.
;c.
.
(4)取12%的硫酸溶液100g配制成6%的溶液,向100g 12%的硫酸溶液中加水的质量应
100g.(填“大于”、“小于”或“等于”)
(5)向100g 24%的氨水中加入100g水,摇匀,溶液体积是
mL.(保留到0.1)



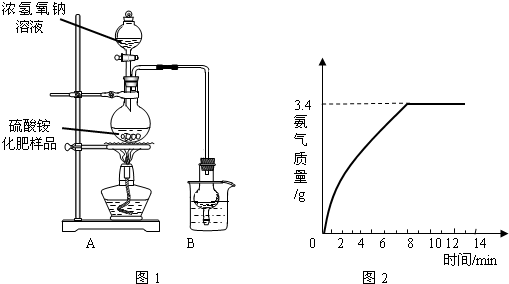

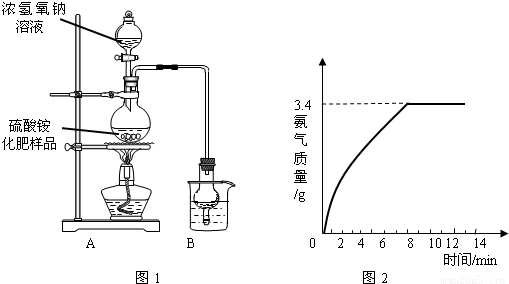
 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O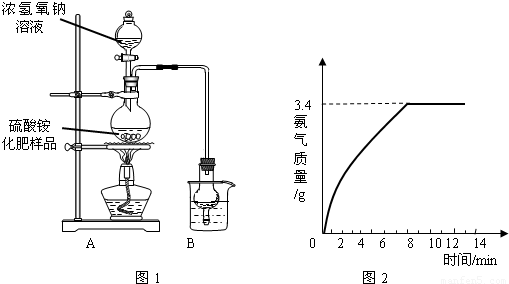
 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O