
����Ŀ��ij��ѧ��ȤС���ͬѧΪ��̽�������ֽⷴӦ����������������������ʵ�飺 ��CuSO4��Һ��NaOH��Һ����CuSO4��Һ��BaCl2��Һ��Ӧ��ʵ�����������ʵ���еķ�Һ����ͬһ���ɾ����ձ��У���ֻ�Ϻ���ˣ��õ���Һ����ɫ��
��1��д��ʵ��ڷ�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��ȡ������Һ���Թ��У�������ɫʯ����Һ��ʯ����ҺΪ��ɫ������Һ���ԣ���ᡱ�����С���������� ��Һ���ձ��л�Ϻ϶������Ļ�ѧ��Ӧ�ķ���ʽ�� ��
��3����С���ͬѧ����Һ�����ʵijɷּ�������������̽��ʵ�飺 ��������⡿��Һ�����ʵijɷ���ʲô��
���������롿С����Ϊ��ֻ���Ȼ��ƣ�
С����Ϊ�����ܺ��������ơ��Ȼ��ƺ��Ȼ�����
С����Ϊ�����ܺ��Ȼ��ƺ��Ȼ�����
����Ϊ������������дһ�ֲ��룩��
�����ۡ�����ΪС�졢С����С����λͬѧ��˭�IJ������Բ�������Ϊʲô��
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
ʵ��A��ȡ������Һ���Թ��У����� | ���������� | ��Һ�в��� |
ʵ��B��ȡ������Һ���Թ��У������������ᱵ��Һ���� | ������ɫ���� | ��Һ�к��� |
��4����������չ��a��Ҫʹ��ɫ��Һ�����ɫ�����˼���NaOH�ȼ�����Һ�⣬����������ɫ��Һ�м��������� �� b����ʢ��100g����������Һ�Ĵ��ձ��л�����������ͭ��Һ����Ӧ���ɳ������������������ͭ��Һ�����Ĺ�ϵ��ͼ��ʾ����ǡ����ȫ��Ӧʱ��������Һ�����ʵ���������������ȷ��0.1% ��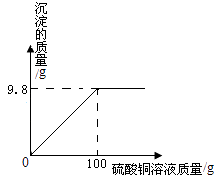
���𰸡�
��1��CuSO4+BaCl2=BaSO4��+CuCl2
��2����CuCl2+2NaOH=Cu��OH��2��+2NaCl
��3���Ȼ��ƺ������ƣ�С������Ϊ�Ȼ����������Ʒ�Ӧ���ɳ�������������Һ�й��棻BaCl2��Na2SO4
��4��Mg��Al��Zn���⣺�����������Ƶ�����Ϊx��
CuSO4+2NaOH= | Na2SO4+ | Cu��OH��2�� |
142 | 98 | |
x | 9.8g |
?? ![]()
x=14.2g
������Һ�����ʵ���������= ![]() =7.5%
=7.5%
��������Һ�����ʵ���������Ϊ7.5%��
���������⣺��1��CuSO4��Һ��BaCl2��Һ��Ӧ�������ᱵ�������Ȼ�ͭ����Ӧ�Ļ�ѧ����ʽ��CuSO4+BaCl2=BaSO4��+CuCl2����2��������Һ����ʹ��ɫʯ����Һ��ɫ������ȡ������Һ���Թ��У�������ɫʯ����Һ��ʯ����ҺΪ��ɫ������Һ�����ԣ���һ����Ӧ��CuSO4��Һ��NaOH��Һ��Ӧ����������ͭ��������������Һ���ڶ�����Ӧ��CuSO4��Һ��BaCl2��Һ��Ӧ�������ᱵ�������Ȼ�ͭ����Ӧ���Һ��һ�����Ȼ�ͭ�������ƣ���Һ��Ϻ����������ҺΪ��ɫ��˵����һ����Ӧ��NaOH��Һ���������Ȼ�ͭ��Ӧ����������ͭ�������Ȼ��ƣ�����ʽ��CuCl2+2NaOH=Cu��OH��2��+2 NaCl����3�����������롿������Һ��ɫ��˵����Һ��һ������ͭ���ӣ���Һ�����ԣ�˵�������������Ȼ�ͭǡ�÷�Ӧ�������Ȼ��ƣ���һ����Ӧ������������Һ��������Һ�е����ʿ������Ȼ��ƺ������ƣ� ���ڶ�����Ӧ���Ȼ��������������Һ�����Ȼ������Ȼ�ͭ�����Ȼ������һ����Ӧ���ɵ�������ǡ�÷�Ӧ�������������Ȼ�ͭǡ�÷�Ӧ������Һ������Ϊ�Ȼ��ƣ�
���ڶ�����Ӧ���Ȼ��������������Һ�����Ȼ������Ȼ�ͭ�����Ȼ������һ����Ӧ���ɵ������Ʒ�Ӧ������ʣ�࣬�����������Ȼ�ͭǡ�÷�Ӧ������Һ������Ϊ�Ȼ��ƺ��Ȼ�����
�����ۡ������ƺ��Ȼ�����Һ��Ӧ���������ᱵ�������Ȼ��ƣ�����С��ͬѧ�IJ������Բ�������
��ʵ��̽����
ʵ��A��ȡ������Һ���Թ��У����������Ĵ�����Һ��������˵����Һ���ޱ����ӣ���Ϊ̼���ƿ����Ȼ�����Ӧ����̼�ᱵ���������Ȼ��ơ������Ʋ���Ӧ����������NaCl��BaCl2��
ʵ��B��ȡ������Һ���Թ��У������������ᱵ��Һ�����������ᱵ��Ӧ���ɳ������������ƣ����Բ������NaCl��Na2SO4 �� �������NaCl��
��ʵ��̽���������ƿ�������������Һ��Ӧ�������ᱵ����������ʵ��ڿ�ȡ������Һ���Թ��У���������������������Һ����
��������չ��a��п����ͭǰ�棬�ҷ�Ӧ����ҺΪ��ɫ���ʿ�ѡп������þҲ�ɣ�
���Դ��ǣ���1��CuSO4+BaCl2=BaSO4��+CuCl2����2���У�CuCl2+2NaOH=Cu��OH��2��+2NaCl����3�����������롿�Ȼ��ƺ������ƣ�
�����ۡ�С������Ϊ�Ȼ����������Ʒ�Ӧ���ɳ�������������Һ�й��棻
ʵ����� | ʵ������ | ʵ����� |
ʵ��A��ȡ������Һ���Թ��У���������������Һ���� | ���������� | ��Һ�в�����BaCl2 |
ʵ��B��ȡ������Һ���Թ��У��� | ������ɫ���� | ��Һ�к��У�Na2SO4 |
��������չ��a��Mg��Al��Zn��
b��7.5%��
�����㾫����������Ҫ��������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ����ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮


 �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Ba��OH��2��Һ��Na2CO3��Һ���ǡ����ȫ��Ӧ����Ӧ��Ļ�����м���ϡ���ᣬ�����������������ϡ���������Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� �� 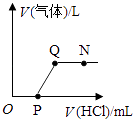
A.N��ʱ��������Һ��pH=7
B.Q��ʱ��������Һ�е�����ֻ����BaCl2
C.O��P�η�����Ӧ�Ļ�ѧ����ʽΪNaOH+2HCl=BaCl2+H2O
D.P��Q�η�����Ӧ�Ļ�ѧ����ʽΪBa��OH��2+2HCl=BaCl2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������л��е���������(������Ϊ����)�����÷�����ȷ���ǣ� ��
A.KClO3����(KCl)�������¼���
B.CO���壨CO2���壩��������ͨ��Ũ���������������������Һ
C.N2��O2����������ͨ�����ȵ�ͭ˿��
D.FeSO4��Һ(CuSO4��Һ)�����μ���������������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������������ǣ� ��
A.��50mL��Ͳ��ȡ5.26mLˮ
B.�����������ȼ�գ���������ɫ����
C.þ��ϡ���ᷴӦ�������壬�ų�����
D.�����ڿ�����ȼ�գ����������İ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ȤС��ͬѧҪ�ⶨij����������ԡ�
��1��ȡ������Ʒ������������ˮ���裬���ú���ˡ���ʵ�����������Ҫ�õ��IJ�����������©���Ͳ�������
��2���ò�����պȡ��������Һ����pH��ֽ�ϣ����ɫ�����պ�ó�pH<7�����Ƭ�������ԣ�Ϊ��������������ԣ�����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�й�����ת����ϵ�У������ʾ�Ϊ���л�ѧ�����Ļ��������BΪ������ᣬDΪ�����к����������ʣ�GΪ��ɫ�����ͼ�С�������ʾ��������֮�������Ӧ����������ʾ���������ʿ��Ƶ������������ʣ��Իش��������⣺ 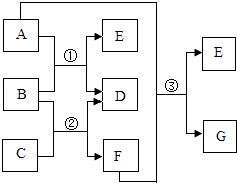
��1��C���ʵĻ�ѧʽΪ ��
��2����ѧ��Ӧ�۵Ļ��������� ��
��3��A�����������Ϊ�������������ᡱ��������Ρ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ���ͬѧ������ˮ��10%����������Һ��������̼�Լ�������ƿ��ƵĶԱ�ʵ�飬����֤��������̼���������Ʒ�����Ӧ��ʵ����������ƿ��ø�����ش� 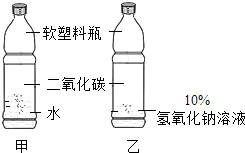
��1����ʵ����Ʋ����϶Ա�ʵ��Ļ���ԭ��Ϊʲô��
��2�����ʵ��̽����Ӧ����ƿ��Һ�����ʵijɷ֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ����ɽ���ֱ����ϡ�����ϡ���ᷴӦֱ���Ƶõ��ǣ�������
A.ZnCl2
B.Fe2��SO4��3
C.AlCl3
D.MgSO4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com