

分析 (1)根据已有的金属的性质进行分析解答,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此解答;
(2)由题意知,反应物为铁和水蒸气、生成物为四氧化三铁和氢气、反应条件为高温,故可书写化学方程式;由化学方程式判定反应类型;
(3)根据相同时间内产生氢气较多(即反应剧烈)的金属活动性较强,结合产生氢气的关系图判断三种金属活动性;
根据一定质量的质量完全反应产生氢气的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,结合三种金属的化合价及完全反应放出氢气的质量大小,判断三种金属的相对原子质量的大小;
(4)Fe、Mg、Zn三种金属分别跟稀盐酸反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=2ZnCl2+H2↑,由此可知,产生氢气的是盐酸中的氢离子,故要得到相同质量的氢气有两种情况:①参与反应的HCl的质量相等;②参与反应的Fe、Mg、Zn的质量符合得到相同质量的氢气的条件
解答 解:(1)铜制火锅利用的是铜的导热性,故填:②;
(2)由题意知,反应物为铁和水蒸气、生成物为四氧化三铁和氢气、反应条件为高温,故可书写化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;此反应符合“单质+化合物=单质+化合物,即A+BC=B+AC”,即为置换反应;
故答案为:3Fe+4H2O(气)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;置换;
(3)A、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内B放出氢气的质量大于,故A不正确;
B、大于C,可判断三种金属中B的活动性最强根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,故B正确;
C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C;因此可判断相对原子质量是C>B>A;故C不正确;
D、根据反应生成H2的质量与反应时间的关系图所示,等质量的三种金属B最先完全反应,因此反应速度最大的是B而不是A;故D不正确;
故选B
(4)①因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等.故D符合;
②假设Fe、Mg、Zn 三种金属分别跟稀盐酸充分反应,得到氢气的质量都是2g,
设参与反应的Fe的质量为x,Mg的质量为y,Zn的质量为z,
Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=2ZnCl2+H2↑,
56 2 24 2 65 2
x 2g y 2g z 2g
$\frac{56}{x}=\frac{2}{2g}$,$\frac{24}{y}=\frac{2}{2g}$,$\frac{65}{z}=\frac{2}{2g}$
解之得:x=56g,y=24g,z=65g,
故Mg、Zn、Fe的质量比为:24g:65g:56g=24:65:56.
故B符合;C不符合;
故选BD.
点评 在利用化学方程式解答问题时,运用假设法,对解题有很大作用.培养学生分析问题、解决问题的能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:选择题
| A. | 氧化物一定含有氧元素,所以含氧元素的物质一定是氧化物 | |
| B. | 化学反应前后原子种类不变,数目没有增减,所以化学反应一定遵循质量守恒定律 | |
| C. | 燃烧一般都伴随发光、放热现象,所以有发光、放热的现象就是燃烧 | |
| D. | 碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
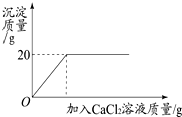 将一定质量的碳酸钠粉末溶于200g水中配制成溶液,向该溶液中加入20%的氯化钙溶液至不再产生白色沉淀,所得产生沉淀的质量与加入氯化钙溶液的质量关系如图所示,试计算:恰好完全反应不再产生白色沉淀时所用氯化钙溶液的质量.
将一定质量的碳酸钠粉末溶于200g水中配制成溶液,向该溶液中加入20%的氯化钙溶液至不再产生白色沉淀,所得产生沉淀的质量与加入氯化钙溶液的质量关系如图所示,试计算:恰好完全反应不再产生白色沉淀时所用氯化钙溶液的质量.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com