
科目:初中化学 来源:不详 题型:单选题
| A.将Zn、Cu两金属片分别放入稀盐酸中 |
| B.将Zn、Fe两金属片分别放人CuCl2溶液中 |
| C.将Fe、Cu两金属片分别放人稀盐酸中 |
| D.将Zn、Cu两金属片分别放人FeCl2溶液中 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
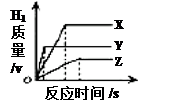
| A.三种金属的活动性顺序为Y>X>Z |
| B.产生氢气的速率顺序为X>Y>Z |
| C.消耗稀盐酸的质量顺序为Z>Y>X |
| D.相对原子质量由大到小的顺序为X>Y>Z |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.常温下,铁比铜更容易生锈 |
| B.在氧气中灼烧时,铁丝要比铜丝反应剧烈 |
| C.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银 |
| D.在同一硫酸中反应时,铝片比锌片反应剧烈 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Ag | B.Fe、Ag | C.Zn、Fe | D.Zn、Fe 、Ag |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.盐酸 | B.稀硫酸 | C.AgNO3 溶液 | D.NaCl溶液 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Zn、 Cu、 Ag | B.Zn、 Fe、Cu |
| C.Ag 、Cu、 Zn | D.Ag 、Zn、Cu |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+ |
| B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解 |
| C.剩余固体可能只含有铜 |
| D.剩余固体中如果有铁,一定也有铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com