
【题目】过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用。现有一瓶过氧化氢溶液,标签如图。

(1)实验室制取氧气时,要将30%的H2O2溶液稀释到6%,其可能原因是_____。
(2)家庭杀菌需配3%的过氧化氢溶液200g,则需30%的H2O2溶液体积_____mL(保留一位小数,下同),加水_____mL。
(3)涂到伤口处有白沫产生,这是因为伤口中有过氧化氢酶,请写出产生泡沫的化学方程式:_____。
【答案】浓度太大,反应速率太快,不利于反应的控制和气体的收集 18.2 180.0 2H2O2 2H2O+O2↑
2H2O+O2↑
【解析】
(1)反应物的浓度、纯度、温度等因素会影响反应速率,通常,浓度越大,反应越快,实验室制取氧气时,要将30%的H2O2溶液稀释到6%,其可能原因是浓度太大,反应速率太快,不利于反应的控制和气体的收集;
(2)溶液稀释前后溶质的质量不变,家庭杀菌需配3%的过氧化氢溶液200g,则需30%的H2O2溶液质量为:![]() =20g,体积为:
=20g,体积为:![]() ;加水的质量为200g-20g=180g, 体积为:
;加水的质量为200g-20g=180g, 体积为:![]() ;
;
(3)产生泡沫的化学反应是过氧化氢在过氧化氢酶的作用下分解生成水和氧气,方程式:2H2O2 2H2O+O2↑。
2H2O+O2↑。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:初中化学 来源: 题型:
【题目】应用中学习物质:利用空气制取氮肥的流程如图所示。

(1)Ⅰ中单质甲化学式是___,它的反应属于__反应(填反应类型)。
(2)Ⅱ中发生反应的化学方程式为______。
(3)物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ__(选填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下图的装置,同学们在老师指导下探究了锌与浓硫酸的反应。(老师告知:①二氧化硫能使品红溶液褪色,B装置用于检验SO2。②浓硫酸与锌反应能生成二氧化硫,但不产生H2,也不会产生O2)请回答下列问题:
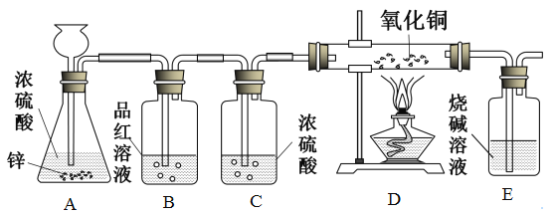
(1)C装置的作用是______
(2)E装置中反应的化学方程式是______。
(3)D装置在点燃酒精灯加热之前应先通一段时间的气体。目的是___;加热一段时间后,观察到____现象,证明气体中含有H2。
(4)锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么反应过程中又产生了氢气呢?用文字简述原因:___。
(5)锌与浓硫酸、稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是______(任填一种合理的答案)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】做电解水实验时,先在水中加入少量含酚酞的硫酸钠溶液(硫酸钠溶液呈中性)再通直流电一段时间,产生的现象如图所示。则下列说法正确的是( )
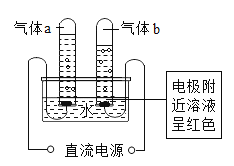
A. 用燃着的木条检验气体a,木条上火焰熄灭
B. 在此反应中硫酸钠的作用是产生氢氧根离子
C. 反应结束后硫酸钠溶液的溶质质量分数不变
D. 与负极相连的电极附近溶液中存在大量氢氧根离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年嫦娥四号探测器成功着陆在月球背面,并通过“鹊桥”中继星传回了近距离拍摄的月背影像图,揭开了月背的神移面纱。
(1)探测器如图所示,图中标示的物质中,属于有机合成材料的是_____。
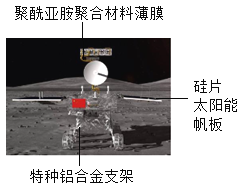
(2)聚酰亚胺聚合材料覆盖在探测器表面,可以保证探测器在温差极大的月球上正常工作,请推测该材料的一条性质_____。
(3)“鹊桥”号上伞状通信天线是用表面镀金的钼丝编织而成的金属网。这种镀金钼丝纤维只有头发丝四分之一细,其性能稳定,“编”出来的金属网既强韧,受得住发射飞行外力“折腾”,又能在太空中收放自如,可以说是“刚柔并济”。
①钼能制成细丝,是利用了钼的_____性。
②钼丝表面镀金,原因之一是利用了金的化学性质_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F均为初中化学中常见的物质,E俗称纯碱,它们之间存在如图的转化关系。“→”表示物质间存在着相应的转化关系,“—”表示物质间能发生反应(部分反应物、生成物和反应条件未标出)。
请问答下列问题:

(1)D的化学式是 ,A的化学式是 。
(2)写出E→F的化学方程式 。
(3)图示转化关系中未涉及到四种基本反应类型中的 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化),下列分析正确的是( )
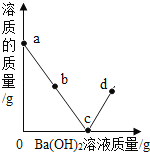
A. a点溶液中有两种溶质
B. b点溶液中滴加紫色石蕊溶液,溶液变蓝
C. c点烧杯内液体的pH=7
D. d点溶液中较多的Ba2+、OH﹣、SO42﹣、H+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~E是初中化学常见的五种不同类别的物质,它们的转化关系如图(部分物质和反应条件略去)。A是目前世界年产量最大的金属;B是红棕色固体;E是我国制碱工业的先驱﹣﹣侯德榜发明的联合制碱法中的“碱”。则C的化学式为_____;化学方程式:①为_____;②为_____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
[推理假设]
上述两种物质发生反应的化学方程式为_______,由此推测出废液中一定有NaCl,可能有_______。
[实验探究]
(1)确定废液中是否含有盐酸:
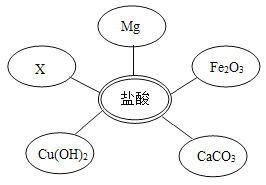
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_____溶液。
②实验验证:某同学向废液中加入少量的铁粉,观察到_____, 确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3;某同学选用______测出废液的pH=10,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、 蒸发结晶 | ______(选填可行或不可行) |
二 | 稍过量的______ | ______ | 可行 |
(4)拓展运用:
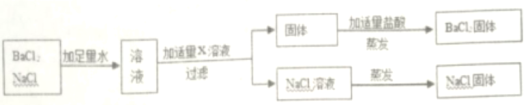
按如下图方案分离BaCl2和NaCl的固体混合物时,x溶液中溶质是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com