
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 3:8 |
分析 根据碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳解答;
解答 解:
碳燃烧的化学方程式为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2
12 32
2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO
24 56
由化学方程式及其质量关系可知,质量比为1:1的碳和氧气反应后,碳过量,碳又和生成的二氧化碳反应生成一氧化碳,充分反应后恢复到常温,密闭容器中的气态物质是二氧化碳和一氧化碳,为混合物;
质量比为1:2的碳和氧气反应后,碳过量,碳又和生成的二氧化碳反应生成一氧化碳,充分反应后恢复到常温,密闭容器中的气态物质是二氧化碳和一氧化碳,为混合物;
质量比为3:4的碳和氧气反应后,碳和氧气恰好完全反应生成的二氧化碳,密闭容器中的气态物质是二氧化碳,为纯净物;
质量比为3:8的碳和氧气反应后,碳和氧气恰好完全反应生成的一氧化碳,密闭容器中的气态物质是一氧化碳,为纯净物;
答案:AB
点评 本题涉及过量问题,比较难,要注意物质之间反应时,不一定恰好完全反应.


科目:初中化学 来源: 题型:选择题
| A. | 蜡烛燃烧生成CO2和H2O,则蜡烛组成里一定含有碳和氢元素 | |
| B. | 氧化物含有氧元素,则含氧元素的化合物都是氧化物 | |
| C. | 碱溶液呈碱性,则呈碱性的溶液一定都是碱溶液 | |
| D. | 使用石油、煤和天然气会排放大量二氧化碳,因此要禁止开发化石能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 请完成下列相关内容:
请完成下列相关内容:| 实验步骤 | 实验现象 | 实验结论 |
| ①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解, 带火星的木条复燃 | 该固体样品中含有Na2O2,其质量为1.56g. |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀 | 化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. | / | / |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 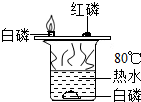 验证可燃物燃烧的条件 | |
| B. | 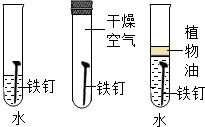 探究铁生锈的条件 | |
| C. | 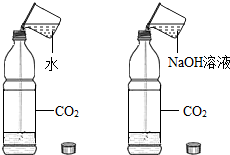 证明CO2和NaOH反应 | |
| D. | 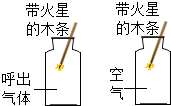 探究呼出气体和空气中氧气含量的不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
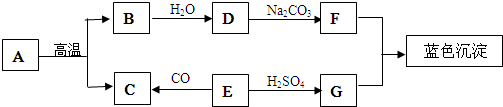
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:填空题
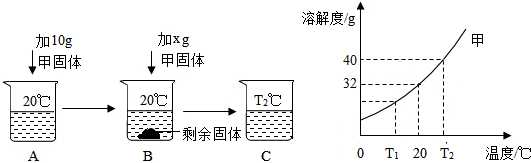
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com