
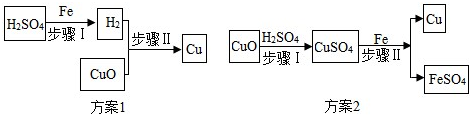
分析 (1)根据氢气和氧化铜反应生成铜和水进行解答;
(2)根据铁和硫酸铜反应生成硫酸亚铁和铜进行解答;
(3)根据判断一个实验方案的好坏要从操作简便,结果明显,环保,节能等角度考虑.
解答 解:(1)氢气和氧化铜反应生成铜和水,方案1制取铜,步骤II反应的现象是黑色固体变为红色,且有水珠出现;
(2)硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(3)方案一在用氢气还原氧化铜需要加热,需要通入大于实际量的氢气,操作复杂,方案二不需加热,操作方便安全,且节省原料、环保,所以比方案一要优越.
故答案为:(1)黑色固体变为红色,且有水珠出现;
(2)Fe+CuSO4=FeSO4+Cu;
(3)方案2好,安全、节能.
点评 本题从化学方程式,实验方案的评价选择等方面进行了考查,综合性强,是一道很好的中考题.


科目:初中化学 来源: 题型:选择题
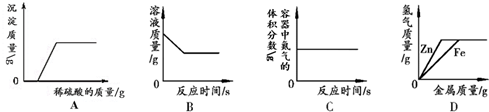
| A. | 向氢氧化钠和硝酸钡的混合溶液中加入足量的稀硫酸 | |
| B. | 向一定量氯化铜溶液中加入铝 | |
| C. | 红磷在装有空气的密闭容器中燃烧 | |
| D. | 向等质量、等质量分数的稀硫酸中分别加入锌粉和铁粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 6 g | B. | 8 g | C. | 13.2 g | D. | 20 g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含有碳、氢两种元素 | |
| B. | 一定含有碳、氢元素、可能含有氧元素 | |
| C. | 碳元素的质量分数为40% | |
| D. | 若相同质量的甲在 8.6g氧气中完全燃烧,只生成二氧化碳和水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图所示,小明和小红在做金属活动性顺序的探究实验,他们将铁钉加入到硫酸铜溶液中,观察到铁钉表面有气泡产生,一段时间后,在铁钉表面附着了红色的固体.
如图所示,小明和小红在做金属活动性顺序的探究实验,他们将铁钉加入到硫酸铜溶液中,观察到铁钉表面有气泡产生,一段时间后,在铁钉表面附着了红色的固体.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com