



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
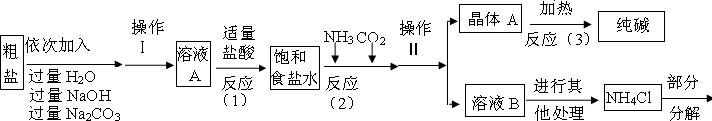
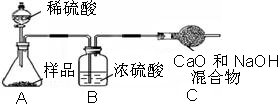 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 现象 | 结论 |
| 取样品置于烧杯中,加入 无色酚酞溶液 无色酚酞溶液 ; |
无色酚酞溶液变红色 无色酚酞溶液变红色 ; |
猜想b不成立 |
| 实验操作 | 现象 | 结论 |
| 取14.6g的白色固体,加入 稀盐酸 稀盐酸 ; |
有气体产生 | 证明白色固体肯定含有 Na2SO3 Na2SO3 ;可能含有 Na2SO4 Na2SO4 . |
| 把上述气体通入氢氧化钠溶液中,测得其增重6.4g | 确认白色固体是 Na2SO3和Na2SO4的混合物 Na2SO3和Na2SO4的混合物 . |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为______(必须要有写出计算过程,请在下方写出)查看答案和解析>>
科目:初中化学 来源:2012年广东省佛山市盐步三中中考化学一模试卷(解析版) 题型:解答题
| 实验操作 | 现象 | 结论 |
| 取样品置于烧杯中,加入 ______; | ______; | 猜想b不成立 |
| 实验操作 | 现象 | 结论 |
| 取14.6g的白色固体,加入 ______; | 有气体产生 | 证明白色固体肯定含有______; 可能含有______. |
| 把上述气体通入氢氧化钠溶液中,测得其增重6.4g | 确认白色固体是______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com