
(6分)现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g溶质质量分数为7.3%的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如下图所示.请计算:
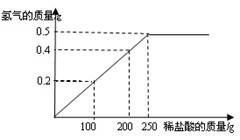
(1)原混合物样品中镁的质量分数是 .
(2)要将剩余的稀盐酸完全反应掉,还需加入该样品的质量是多少?(简要写出计算过程)
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:初中化学 来源:2012届江苏省泰兴市实验初级中学九年级第二次模拟考试化学试卷(带解析) 题型:计算题
(6分)现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g溶质质量分数为7.3%的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如下图所示.请计算: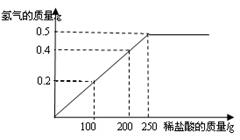
(1)原混合物样品中镁的质量分数是 .
(2)要将剩余的稀盐酸完全反应掉,还需加入该样品的质量是多少?(简要写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com