(2012?连云港)一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
【资料获悉】铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.
【教师指导】铁被氧气氧化最终产物为红棕色的Fe
2O
3(其他产物忽略不计).
【探究目的】小组同学欲探究该“脱氧剂”是否已经失效(即单质铁是否已经完全被氧化),并测定各成分的质量分数,设计了以下探究实验.
【实验探究】
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
步骤2:称取10.00g样品与一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为7.28g.
步骤3:按如下装置,将得到的7.28g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.15g.
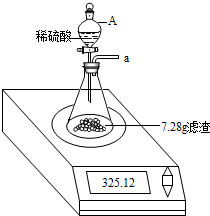
步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g.
【交流讨论】
(1)由步骤1得出的结论是
样品中含有单质的铁
样品中含有单质的铁
.
(2)步骤2目的是
溶解样品中氯化钠
溶解样品中氯化钠
,检验该滤液中溶质的方法是
取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠
取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠
.
(3)步骤3中仪器A的名称为
分液漏斗
分液漏斗
.
小明认为0.15g差值即为H
2的质量,并由此计算出样品中单质铁的质量为4.20g.
小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是
防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差
防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差
.
(4)如果步骤4中滤渣没有经过洗涤,则称得的质量
>
>
1.20g(填“>”或“=”或“<”)
【教师指导】样品在稀硫酸中除了Fe、Fe
2O
3分别能与稀硫酸反应外,还存在反应:Fe+Fe
2(SO
4)
3=3FeSO
4.因此,小明用产生H
2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe
2(SO
4)
3反应消耗铁的质量总和.
【学生实验】小红将步骤3的装置进行了改进,重新称取10.00g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.14g.
【数据处理】由于反应过程较复杂,小组同学在老师的帮助下,推算出与Fe
2(SO
4)
3反应消耗铁的质量为0.56g.
【请你参与】
(1)写出Fe
2O
3与稀硫酸反应的化学方程式.
(2)请根据以上数据,计算该样品中各成分的质量分数.



 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案