
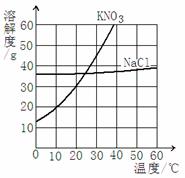
某同学根据右图所示溶解度曲线获得以下信息,其中正确的是
A、10℃时KNO3的溶解度大于NaCl的溶解度
B、30℃时KNO3的溶解度大于NaCl的溶解度
C、KNO3的溶解随温度的升高而减小
D、NaCl的溶解度与KNO3的溶解度不可能相等
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| 物质 | 钠与冷水 | 镁与冷水 | 镁与水蒸气 | 铁与冷水 | 铁与水蒸气 |
| 能否发 生反应 |
剧烈反应 | 缓慢反应 | ? | 不反应 | 加热条件 下能反应 |
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 | 漂白粉 |
| 产品样式 |  |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |
| 实验步骤 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, 滴入适量品红溶液 滴入适量品红溶液 . |
溶液红色不褪去 溶液红色不褪去 . |
漂白粉的漂白作用已完全失效. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||

| 实验步骤 | 实验现象 | 实验结论 |
取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. 取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. |
产生无色气泡,澄清石灰水变浑浊 产生无色气泡,澄清石灰水变浑浊 |
该样品是NaHCO3否则是Na2CO3 该样品是NaHCO3否则是Na2CO3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com