
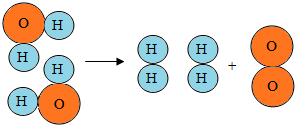
| A. | 这是一个化合反应 | |
| B. | 在化学变化中氢原子和氧原子是最小的粒子 | |
| C. | 水是由氢气和氧气组成的 | |
| D. | 在化学变化中氢分子和氧分子都没有发生变化 |
分析 A、根据反应的特点对反应的类型进行判断;
B、根据微粒的变化分析分子原子的变化等;
C、根据微粒的构成分析物质的组成;
D、根据微粒的变化分析分子原子的变化等.
解答 解:A、由水分子分解示意图可知,该反应由一种物质反应后生成两种物质的反应,为分解反应而不是化合反应,故A不正确;
B、由微粒的变化可知,在化学变化中氢原子和氧原子没有变化,是化学变化中的最小的粒子,故B正确;
C、由微粒的构成可知,水是由氢元素和氧元素组成的,故C不正确;
D、由微粒的变化可知,在化学变化中氢原子和氧原子都没有发生变化,氢分子和氧分子是生成物,故D不正确.
故选B.
点评 变化的微观示意图,可以直观地反映出变化发生的过程,根据对变化过程中各物质构成的对比与分析,可判断化学变化的实质:分子变成原子,原子重新结合成新的分子.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:初中化学 来源: 题型:选择题
| A. | NaCl Ca(ClO)2 KClO3 | B. | Cl2 HCl ClO2 | ||
| C. | KClO3 NaClO2 HClO4 | D. | NH4ClO4 Cl2O3 HClO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
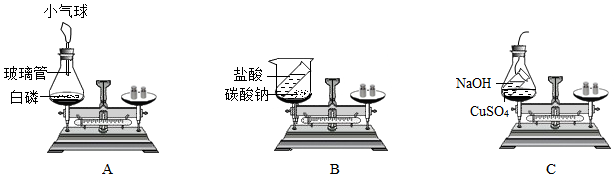
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
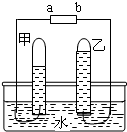 如图是电解水的简易装置.
如图是电解水的简易装置.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
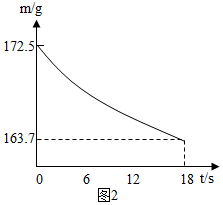
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2FeO4是一种纯净物 | |
| B. | K2FeO4由三种元素组成 | |
| C. | K2FeO4中钾、铁、氧三种元素的质量比是2:1:4 | |
| D. | K2FeO4的相对分子质量是198 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com