
 20℃时,分别向盛有30克水的两只烧杯中加入等质量的KNO3(A杯)、NaCl(B杯)两种固体物质,使其充分溶解可观察到如图所示的现象.则20℃时NaCl的溶解度比KNO3的溶解度大(填“大”或“小”或“不可比”).该同学又取等质量的50℃时的两杯NaCl和KNO3的饱和溶液冷却到室温.发现A(填“A”或“B”)杯中有较多晶体析出.而另一杯中析出的晶体极少.小明同学由比想到.如果要除去KNO3中的少量NaCl,可采用的方法是降温结晶.
20℃时,分别向盛有30克水的两只烧杯中加入等质量的KNO3(A杯)、NaCl(B杯)两种固体物质,使其充分溶解可观察到如图所示的现象.则20℃时NaCl的溶解度比KNO3的溶解度大(填“大”或“小”或“不可比”).该同学又取等质量的50℃时的两杯NaCl和KNO3的饱和溶液冷却到室温.发现A(填“A”或“B”)杯中有较多晶体析出.而另一杯中析出的晶体极少.小明同学由比想到.如果要除去KNO3中的少量NaCl,可采用的方法是降温结晶. 分析 根据图可知,一定温度一定溶剂中A中有固体不溶解,而B中没有,再根据固体的溶解度随温度的变化来解答降温时饱和溶液中晶体的析出.
解答 解:因20℃时,分别向盛有30克水的两只烧杯中加入等质量的NaCl、KNO3两种固体物质,
由图可知,A中有固体不溶解,而B中没有,所以A中溶解的质量少,B中溶解的质量多,所以氯化钠的溶解度大;
50℃时,溶液所溶解的NaCl和KNO3都已饱和,把该溶液冷却到室温,有晶体析出,
根据氯化钠的溶解度受温度的影响变化不大,硝酸钾的溶解度随温度的变化而变化,且变化程度大,
则饱和溶液降温,受温度影响大的固体会从溶液中析出溶质多.硝酸钾的溶解度受温度影响较大,所以提纯硝酸钾的方法是降温结晶.
故答案为:大;A;降温结晶.
点评 本题考查学生饱和溶液的判断及溶解度随温度变化的关系,学生应理解饱和溶液的概念,熟记常见物质的溶解度随温度变化而发生的变化来解答.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:初中化学 来源: 题型:解答题

| 实 验 操 作 | 预期实验现象 | 结 论 |
| 取少量固体产物,向其中加入足量的稀盐酸. | 有气泡产生 | 固体产物是Na2CO3,而不是NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲:证明木炭燃烧生成二氧化碳 | B. | 确定空气中氧气含量 | ||
| C. | 丙:探究铁、铜、银金属活动性强弱 | D. | 丁:探究可燃物的燃烧需要氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | |
| 实验1 | 取样与试管中,加入食醋,并将产生气体通入澄清石灰水中. | 有气泡产生,石灰水变浑浊. |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |
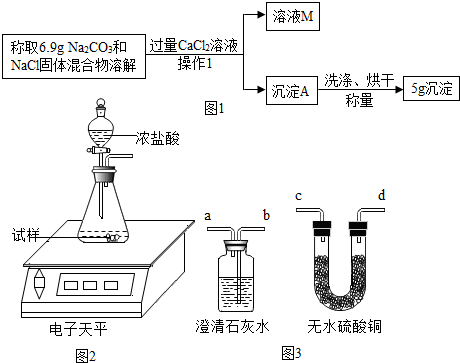
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 14.6% | B. | 7.3% | C. | 18.25% | D. | 10.0% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ①③中的各物质间的转化均可一步实现 | |
| B. | ①中的反应a所体现的冶炼技术是现代湿法冶金的先驱 | |
| C. | ②中的物质b可以是CaCl2或Ca(OH)2 | |
| D. | ③中的反应c的条件是高温,反应d可将其他形式的能量转化为化学能 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向滤渣中加稀盐酸,一定有气泡产生 | |
| B. | 向滤液中加稀盐酸,可能有沉淀产生 | |
| C. | 滤渣中一定含Ag,可能含有Fe和Al | |
| D. | 滤液中一定含Fe(NO3)2,可能含Al(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 竖着试管将锌粒直接投入其中 | |
| B. | 取用药品后及时盖紧瓶盖 | |
| C. | 用过的滴管都要用清水清洗 | |
| D. | 如果没有说明用量,液体药品一般取用5~10mL |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
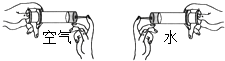 《运动的水分子》这节课上,老师让同学做了如图对照试验,其中所得结论不正确的是( )
《运动的水分子》这节课上,老师让同学做了如图对照试验,其中所得结论不正确的是( )| A. | 水是由水分子构成的 | |
| B. | 空气是由空气分子构成的 | |
| C. | 装空气的注射器容易被压缩是因为气体分子间间隔较大 | |
| D. | 空气被压缩,水被压缩都属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com