50g 19.6%的稀硫酸加入40g氢氧化钠溶液中能恰好完全反应.
(1)所用氢氧化钠溶液中溶质的质量分数为______.
(2)反应所得的溶液中溶质的质量分数 (精确到0.1%)
(3)现有30g 30%的氢氧化钠溶液和5g氢氧化钠固体以及若干蒸馏水,最多可配制这种溶液多少?
【答案】
分析:(1)根据化学方程式中稀硫酸的质量可求出反应的氢氧化钠质量,进而可知氢氧化钠的溶质质量分数;
(2)依据化学反应方程式也可计算生成的硫酸钠的质量,进而可计算所得溶液的溶质质量分数;
(3)依据溶液配制前后溶液的溶质质量不变进行分析即可;
解答:解:(1)设所用氢氧化钠溶液中溶质的质量分数为x,反应后生成的硫酸钠质量为y;
H
2SO
4 +2NaOH=2H
2O+Na
2SO
4
98 80 142
50g×19.6% 40g×x y
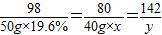
x=20%
y=14.2g
(2)反应所得的溶液中溶质的质量分数为
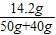
×100%≈15.8%
(3)设配制这种溶液的质量为z
30g×30%+5=z×20%
z=70g
故答案为:(1)20%.(2)答:反应所得的溶液中溶质的质量分数为15.8%;(3)答:现有30g 30%的氢氧化钠溶液和5g氢氧化钠固体以及若干蒸馏水,最多可配制这种溶液70g;
点评:本题主要考查学生运用化学方程式进行计算的能力,数量掌握相关的溶液及化学方程式基本计算是解题的关键所在;

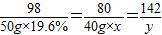
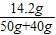 ×100%≈15.8%
×100%≈15.8%
