23、人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究.
(1)以下工具的制作过程中没有发生化学变化的是(
A
)
A.原始人制作石刀;B.冶炼青铜;C.炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序
B.A.C
(填序号).
A.铁;B.青铜;C.铝
从以上顺序可以看出,金属制品的出现顺序与
金属活动性
有关,那么金属钾的制得应排在
C
之后.
(3)金属区别于非金属的主要物理性质是,金属具有
金属光泽
,金属区别于非金属的主要化学特征是
良好的传热导电性
.在化学变化中金属原子通常表现为
延展性易失去电子
.
(4)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu
2(OH)
2CO
3△2CuO+H
2O+CO
2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:
2CuO+2C═2Cu+CO2↑
(5)古代术士将炉甘石(主要成分为ZnCO
3)与赤铜矿(Cu
2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗?
不能,在化学变化过程中元素种类不可能发生改变
.
②那么你认为这金光灿灿的金属是什么?它是怎么炼出来的?写出有关化学方程式
该金属可能是
铜锌合金
,炼出它的化学方程式为
ZnCO3═ZnO+CO2↑
、
2ZnO+C═2Zn+CO2↑
、
2Cu2O+C═4Cu+CO2↑
.
(6)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:
Fe+CuSO4═Cu+FeSO4
(7)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y
2BaCu
6O
10,它是以Y
mO
n、BaCO
3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,试填写以下空白:
a.超导材料Y
2BaCu
6O
10是由
四
种元素组成的,Y
mO
n的化学式是:
Y2O3
b.在合成该超导材料的同时还生成-种产物,该物质是
CO2
(写化学式).
金属的使用及冶炼历史也引起同学们极大兴趣,初三同学组织化学兴趣小组继续进行(8)(9)探究:
(8)首先他们收集大量有关钢铁的成语与民间谚语.其中有说明钢的性能比铁好的有
恨铁不成钢
,知道“百炼成钢”是指铁在高温条件下反复敲打发生的反应是:
C+O2═CO2
,从而了解钢与铁的机械性能不同是因为两者
含碳量不等
.
(9)钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]a. Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是
除去氧化膜利于直接反应
.
[实验现象]
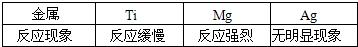
[实验结论]原假设中
a
不正确,理由是
镁反应速率比钛快
.
[结论]用不同浓度的足量稀盐酸反应,是否也能得出同样结论?
否
,请说明理由
反应速率与反应物浓度有关
(10)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H
2SO
4反应的实验,实验
结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H
2SO
4反应放出H
2的函数图象(如图所示).
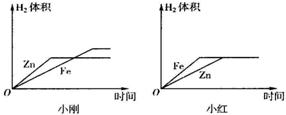
两个图象中存在有错误的是
小红
的图象,判断错误的理由是
图象中Fe与Zn标反了,Zn的反应速率较Fe快
,
图象不同的原因是
小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完
.
由该实验可以得到的结论:
①金属与酸反应的速率与
金属活动性
有关.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与
相对原子质量
有关.
(11)将铁粉加到一定量的硝酸银、硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,在滤液中滴加盐酸,没有白色沉淀生成,则滤渣中一定有
Ag、Zn(NO3)2
,肯定滤液中有
Fe(NO3)2
.
(12)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一
种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H
2SO
4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
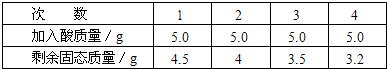
试求:①合金中铜的质量分数
64%
.②合金中另一金属为何种金属.
另一种金属为锌
.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________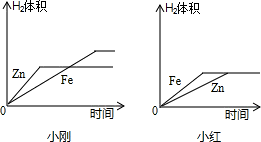
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:_________

