
【题目】以孔雀石为原料制取胆矾(CuSO45H2O)的部分工艺流程如图所示。
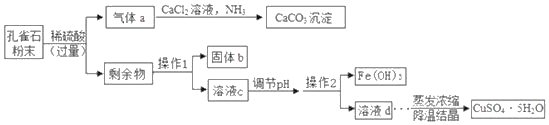
(查阅资料)
I.孔雀石主要成分为Cu2(OH)2CO3,还有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。
Ⅱ.胆矶是一种蓝色晶体,受热易分解。
Ⅲ.在该实验条件下,Fe(OH)3、Cu(OHI)2沉淀的pH如下表:
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.14 | 4.2 |
完全沉淀的pH | 3.0 | 6.7 |
(1)操作1的名称为_____,实验室进行该操作时玻璃棒的作用是_____。
(2)气体a生成CaCO3的同时还生成NH4C1,该反应的化学方程式为_____。
(3)溶液c中的溶质有:CuSO4、H2SO4和_____(写化学式)
(4)为将溶液中的Fe3+全部转化为Fe(OH)3,沉淀而Cu2+不转化为Cu(OH)2沉淀,应调节pH=m,m的范围是_____。
(5)获得胆矾晶体时采用降温结晶而不用蒸发结晶的主要原因是_____。
【答案】过滤 引流 CaCl2+CO2+H2O+2NH3═CaCO3↓+2NH4Cl Fe2(SO4)3 3.0≤m<4.2 防止胆矾受热分解
【解析】
(1)操作1得到的是固体和液体,所以过滤,实验室进行该操作时玻璃棒的作用是引流,从而防止液体外撒。
(2)气体a生成CaCO3的同时还生成NH4C1,是和氨气以及氯化钙反应,所以该反应的化学方程式为 CaCl2+CO2+H2O+2NH3═CaCO3↓+2NH4Cl。
(3)雀石主要成分为Cu2(OH)2CO3,还有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质,和过量硫酸反应时,有剩余的硫酸以及生成的硫酸铜和硫酸铁,所以溶液c中的溶质的化学式为:CuSO4、H2SO4和 Fe2(SO4)3。
(4)为将溶液中的Fe3+全部转化为Fe(OH)3,沉淀而Cu2+不转化为Cu(OH)2沉淀,应调节pH=m,需要不低于氢氧化铁完全沉淀而氢氧化铜开始生成沉淀的pH,所以m的范围是 3.0≤m<4.2。
(5)获得胆矾晶体时,由于胆矾是含结晶水的化合物,为避免胆矾受热分解而失去结晶水,所以采用降温结晶而不用蒸发结晶,所以主要原因是 防止胆矾受热分解。
故答案为:
(1)过滤; 引流。
(2)CaCl2+CO2+H2O+2NH3═CaCO3↓+2NH4Cl。
(3)Fe2(SO4)3。
(4)3.0≤m<4.2。
(5)防止胆矾受热分解。


科目:初中化学 来源: 题型:
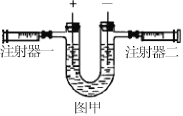
【题目】用图甲所示的电解水装置来测定水的组成。
【实验步骤】
(1)按图安装好装置,检验装置气密性。
(2)在U型管中装入水(水面略低于支管口)。
(3)取下注射器,打开电源一段时间后,关闭电源。
(4)将注射器活塞推到顶后连接注射器,再次打开电源。
当注射器二中活塞停留在10mL刻度时,关闭电源。
(5)检验气体。
【实验结论】水是由 组成的。电解水的符号表达式 。
【问题讨论】
(1)实验开始时先打开电源通电一段时间后再接上注射器的目的是 。
(2)实验结束时注射器一中活塞停留在 刻度处。将该注射器带上针头,移向燃着的木条旁,推动活塞,现象是 。
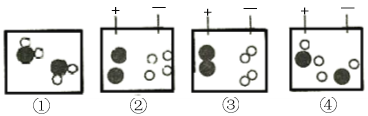
(3)水电解的过程可用下列图示表示。粒子运动的先后顺序是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学概念在逻辑上可能存在如图所示关系,对下列概念说法正确的是( )
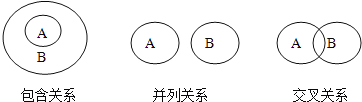
A. 纯净物与混合物属于包含关系
B. 化合物与氧化物属于并列关系
C. 单质与化合物属于交叉关系
D. 化合反应与分解反应属于并列关系
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |||||||||
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |||||||||
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
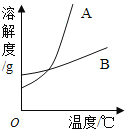
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解 度,则温度的范围是 ;
(3)某兴趣小组做了一下实验:
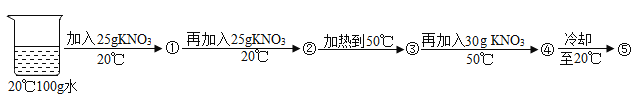
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语表示。
(1)一个氧原子_____;
(2)三个铵根离子:_____;
(3)氧化铁中铁元素的化合价为+3_____;
(4)已知磷酸钙的化学式为Ca3(PO4)3,则磷酸的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图,回答问题:

(1)连接导气管时,与橡胶管相连的玻璃管口应_____。
(2)实验室用A制取氧气,其反应的化学方程式为_____。若要收集较纯净的氧气,其收集装置应选_____(填字母代号);待收集完毕后应先_____再_____。
(3)实验室制取二氧化碳的化学方程式为_____,发生装置和收集装置应选_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)我省两淮地区煤炭资源丰富,瓦斯存在于煤层及周围岩层中,是井下有害气体的总称,主要成分是甲烷。
(1)请你写出甲烷完全燃烧的化学方程式:__________________________________。
(2)煤矿瓦斯爆炸有两个必要条件:
①瓦斯含量在爆炸极限的范围内;②________________________________________。
(3)下表是常见三种气体的爆炸极限,请你据此判断:
最容易发生爆炸的气体是____。
可燃气体 | 爆炸极限(体积分数) |
H2 | 4.0%~74.2% |
CH4 | 5%~15% |
CO | 12.5%~74.2% |
(4)下列图标中,与燃烧和爆炸无关的是
![]()
A B C D
(5)某现代化的矿井采用了“低浓度瓦斯发电技术”,有效解决了矿区及周边地区的照明用电。这种既采煤又发电联合生产的优点是___________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,某化学兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,并用热重法(TG)确定其分解后所得固体产物的组成,探究过程如下:
(查阅资料)
①硫酸铜晶体(CuSO45H2O)受热时会发生如下反应: CuSO45H2O![]() CuSO4+5H2O草酸亚铁晶体(FeC2O42H2O)也能发生类似的反应;
CuSO4+5H2O草酸亚铁晶体(FeC2O42H2O)也能发生类似的反应;
②草酸亚铁晶体热分解的气体产物是H2O,CO,CO2;
③白色的无水CuSO4遇水蒸气会变成蓝色;
④浓硫酸具有吸水性,是常用的气体干燥剂;
⑤浓的氢氧化钠溶液易吸收大量的二氧化碳气体,比石灰水吸收效果好。
(实验设计)
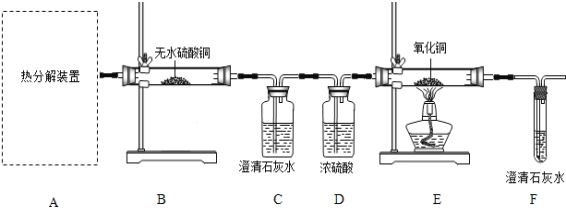
(1)从环保角度考虑,该套实验装置的明显缺陷是_______。
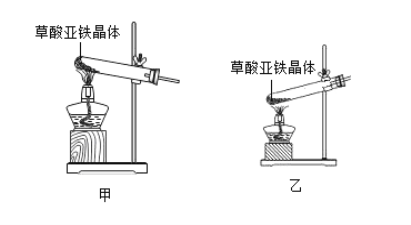
(2)可选择以下实验装置中的_____(选填“甲”或“乙”)作为虚线中的“热分解装置”。
(问题讨论)
(3)实验过程中如果观察到以下现象:B中白色无水CuSO4变成蓝色,___________,E中黑色粉末变成红色,则可证明草酸亚铁晶体热分解的气体产物是H2O,CO,CO2;写出F装置中所发生反应的化学方程式_________。
(4)该兴趣小组进行上述实验时,应先点燃__________处(填“A”或“E”)的酒精灯,原因是____________。
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有CO,则需对实验设计方案进行改进,请说出你的改进措施________。
(数据分析)
(6)称取3.60g草酸亚铁晶体(FeC2O42H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,请分析该图回答下列问题:
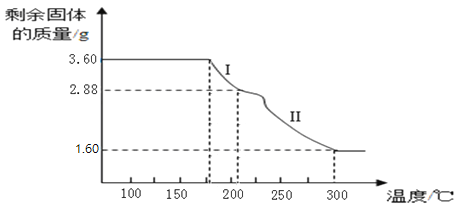
①过程Ⅰ发生反应的化学方程式为____________。
②已知:300℃时草酸亚铁晶体完全分解后剩余固体只有一种且是铁的氧化物。通过计算可确定该氧化物为_____________(填名称)。(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(12分)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。
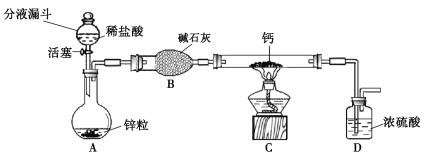
图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为 。(结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com