
【题目】如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是( )
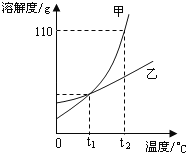
A.t1℃时,甲、乙两种物质的饱和溶液中溶质质量一定相等
B.t2℃时,甲的溶解度大于乙的溶解度
C.甲中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时,向60g甲固体中加入50g水,充分搅拌后能得到105g溶液
【答案】A
【解析】
试题分析:A、t1℃时,甲和乙的溶解度相等,甲、乙两种物质的饱和溶液中溶质质量分数相等,但是没说明溶液质量,不能判断含溶质是否相等,故A说法错误;
B、从t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小是甲>乙,故B说法正确;
C、如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于甲的溶解度受温度影响较大,所以用冷却热饱和溶液的方法提纯甲,故C说法正确;
D、t2℃甲物质的溶解度是110g,即在t2℃100g水中最多溶解110g甲物质,所以50g水中最多溶解55g甲物质,所得溶液质量为:55g+50g=105g,故D说法正确.
故选A.


科目:初中化学 来源: 题型:
【题目】现有A~G七种物质,已知A是赤铁矿石的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系。

(1)写出下列物质的化学式: D________ F__________
(2)写出反应①的化学方程式________________
(3)写出物质A与E的稀溶液反应的发生反应的化学方程式__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:
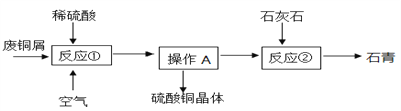
【产品制备】
(1)反应①在80℃条件下制备硫酸铜,其化学方程式为________,该化工厂后期发现,可用纯氧代替空气,既能加快反应速率又能________。
(2)硫酸铜晶体(CuSO45H2O)的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
操作A具体过程是:除杂,______、降温到30℃结晶、过滤、冰水洗涤、低温烘干。过滤时玻璃棒的作用是_____,剩余硫酸铜溶液的溶质质量分数为______,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是______。
(3)车间将CuSO4·5H2O、生石灰分别与水按1:50的质量比混合,然后把得到的两种液体在木桶里来配制波尔多液,该过程发生的化合反应的方程式为_________。
【组成测定为测定其组成】小组同学称取石青样品,用如图装置进行实验。
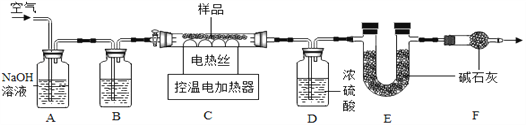
查阅资料:①石青的化学式可表示为aCuCO3b Cu(OH)2;②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
实验步骤:①连接仪器, ,准确称取34.6g aCuCO3bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞, ;⑤冷却后,称量,装置D增重1.8g,装置E增重8.8g。
(4)完善实验步骤中的填空:①________;④__________。
(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______(填名称)。
(6)通过计算可得:a:b=__________。(写出实验过程2分)
(7)若缺少F装置,测得的a:b________(选填“偏大”、“偏小”、“不变”)。
【脱水探究】
硫酸铜晶体受热会逐步失去结晶水。取纯净CuSO45H2O固体2.50g,放在上图实验装置C中进行加热,测定固质量随温度的变化情况如图所示。
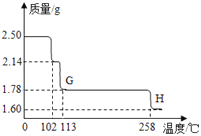
(8)G点固体的化学式是_________。
(9)G→H看到的现象是_________。
(10)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲乙丙有如图所示的转化关系(“→”表示反应一步实现,部分反应物和反应条件略去),下列各组物质按照甲乙丙的顺序不符合要求的是

A.C、CO2、CO
B.H2O2、O2、H2O
C.CuO、Cu、Cu(NO3)2
D.NaOH、NaCl、NaNO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下列仪器进行气体的制取实验。请根据要求填空。
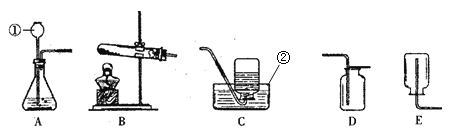
(1)实验室为制取一瓶较纯净的氧气,选取了加热氯酸钾与二氧化锰的方法,应选取的装置组合是_______________(填字母,下同),如果改用过氧化氢溶液制取氧气,制取1.6g氧气,需要5%的过氧化氢溶液的质量为:______g。
(2)实验室用硫化亚铁(FeS)固体与稀硫酸混合制硫化氢气体,该反应的化学方程式是_______,选用的发生装置是_________;
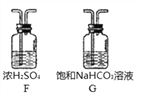
(3)某同学用大理石与浓盐酸反应制取二氧化碳时,发现收集到的二氧化碳气体中混入大量氯化氢气体和水蒸气,于是使用了下边装置进行处理,得到纯净、干燥的二氧化碳。那么混合气体应先进入装置_______再进入装置________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】欲测定 Cu-Zn 合金及 Cu-Ag 合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀 H2SO4 和必要的仪器.为了测定合金的组成,某同学取四份合金样品分别加人稀 H2SO4 充分反 应,得到如下实验数据:


(1)你认为能测出质量分数的合金是______。
(2)第 4 份产生的气体的质量是______。
(3)所加稀 H2SO4 的浓度是多少_______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:
①反应I是粗盐除杂;
②反应II是特殊条件下电解NaCl溶液制NaClO3;
③反应Ⅲ是ClO2的制取。其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。
工艺流程如图,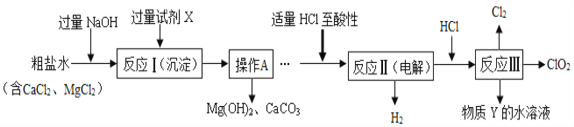
(1)加入过量氢氧化钠的目的是__________________________。
(2)过量的试剂X是_______(填化学式),操作A的名称是_____________。
(3)写出反应I中的一个反应方程式______________________________。
(4)加入适量HCl除为了满足电解时的微酸性外,还能除去溶液中的杂质离子,请写出其中所发生的中和反应的化学方程式:_____________。
(5)该流程中可循环利用的物质是水和___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“人工固氮”的新方法的反应过程示意图如下:
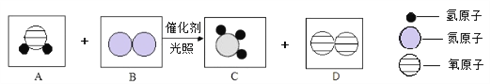
(1)依据反应的微观示意图写出化学方程式____________。
(2)氨气进入大气后与雨水作用,可能形成“碱雨”。写出碱雨中的碱的化学式,并标出其中氮元素的化合价________________。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:

① 加入的X 应为________________(填字母序号)。
A.H2SO4 B.CaSO4 C.SO2
②生产流程中能被循环利用的物质是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一混合气体,经测定只含有甲烷和一氧化碳,现将 11.6g 该混合气体在氧气中充分燃烧,并 将生成物先后依次通过足量的浓硫酸和碱石灰(已知:碱石灰是氢氧化钠和氧化钙的混合物), 确保每一步都被充分吸收,测得浓硫酸增重 7.2g。下列说法不.正.确.的是
A. 碱石灰增 22g B. 混合气体中一氧化碳质量为 8.4g
C. 混合气体中碳、氢元素的质量比为 15:2 D. 混合气体中甲烷与一氧化碳分子数之比为 3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com