
| A. | 用食醋除去水壶中的水垢 | B. | 用灼烧的方法区别羊毛线和棉线 | ||
| C. | 铁钉锈蚀条件的探究 | D. | 用活性炭净化水 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断.
解答 解:A、用食醋除去水壶中的水垢,水垢的主要成分是碳酸钙和碳酸镁等,食醋和其反应,生成可溶性的盐,属于化学变化;
B、用灼烧的方法区别羊毛线和棉线,属于物质的燃烧,有新物质生成,属于化学变化;
C、铁钉锈蚀条件的探究需要通过铁钉是否容易生锈来验证,铁生锈有主要成分是氧化铁的物质生成,属于化学变化;
D、用活性炭净化水是利用了活性炭的吸附性,吸附过程中没有新物质生成,属于物理变化.
故选D.
点评 本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.


科目:初中化学 来源: 题型:解答题
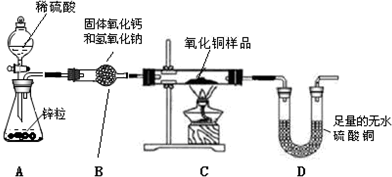
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
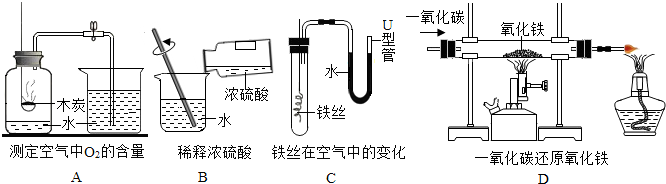
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
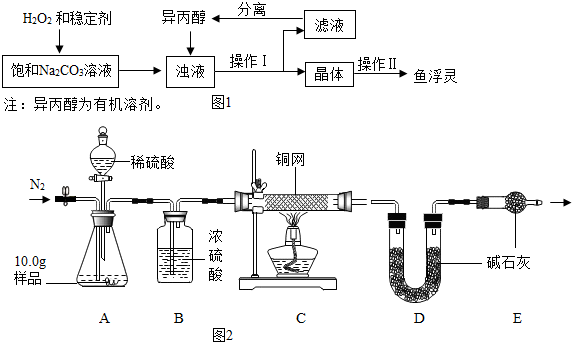
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | K2CO3、FeCl3、KOH、H2SO4 | B. | NaCl、MgCl2、K2SO4、CuSO4 | ||
| C. | NH4HCO3、Ba(OH)2、H2SO4、NaNO3 | D. | K2CO3、Na2SO4、BaCl2、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | 20% | D. | 22.5% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 等于7 | B. | 小于7 | ||
| C. | 大于7 | D. | 无法确定大于、小于或等于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com