

分析 (1)反应物接触面积越大,反应速率越快;
(2)根据反应过程可以判断溶液中的溶质;
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
(4)根据生产工艺过程,可以判断循环使用的物质.
解答 解:(1)粉碎:用粉碎机将铝土矿石粉碎成粉末.粉碎的目的是增大反应物接触面积,加快反应速率.
故填:增大反应物接触面积,加快反应速率.
(2)溶出液中一定含有的溶质是反应生成的NaAlO2和过量的NaOH.
故填:NaAlO2、NaOH.
(3)Na2CO3与石灰乳中的氢氧化钙反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)该生产工艺中,可以循环使用的物质是氢氧化钠,这是因为苛化过程中反应生成的氢氧化钠可以用作溶出过程中的原料.
故填:NaOH.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:解答题
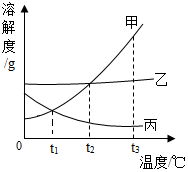 根据如图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题.
根据如图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | 2HCl+Ca(OH)2═CaCl2+2H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水有“自净”功能,少量工业废水可以直接排放到河流中 | |
| B. | 水中氮、磷元素增多可导致水的硬度增大 | |
| C. | 经过沉淀,过滤得到的矿泉水是纯净物 | |
| D. | 工业上冷却用水的循环使用可以节约用水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加热试管时,先使试管底部均匀受热,后用酒精灯的外焰固定加热 | |
| B. | 制取气体时,先装药品,后检查装置的气密性 | |
| C. | 加热KClO3并用排水法收集O2实验结束时,先熄灭酒精灯,后移出导管 | |
| D. | 稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com