将65克不纯的锌片与足量的硫酸铜溶液充分反应后得到64克铜,则下列情况有可能是( )
A.锌片中含有铜和镁
B.锌片中含有铁
C.锌表面含有氧化锌
D.锌片中含有碳和铁
【答案】
分析:根据稀与硫酸铜反应的化学方程式计算得到64g铜需要纯金属锌的质量恰好为65g,则混入的杂质中一定要有含有能生成铜的物质,且含有的物质中一定含有生成相同质量的铜消耗杂质金属比消耗的锌多与少的两种物质,采用极端假设法进行分析解答即可.
解答:解:设得到64g铜需要金属锌的质量为x
Zn+CuSO
4═ZnSO
4+Cu
65 64
x 64g
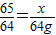
x=65g
由题意,65克不纯的锌片含有杂质,混入的杂质中一定要有含有能生成铜的物质,且含有的物质中一定含有生成相同质量的铜消耗杂质金属比消耗的锌多与少的两种物质.
A、铜不与硫酸铜反应,镁与硫酸铜反应的化学方程式为:Mg+CuSO
4═MgSO
4+Cu,镁的相对原子质量为24,生成64g铜消耗的镁的质量为24g,小于65g;则锌、铜、镁的混合物与硫酸铜反应生成64g铜所需金属混合物的质量有可能为65g,故选项正确.
B、铁与硫酸铜反应的化学方程式为:Fe+CuSO
4═FeSO
4+Cu,铁的相对原子质量为56,生成64g铜消耗的铁的质量为56g,则锌、铁的化合物与硫酸铜反应生成64g铜所需金属混合物的质量小于65g,故选项错误.
C、氧化锌不与硫酸铜反应,则含氧化锌的锌片65g生成铜的质量小于65g,故选项错误.
D、碳不与硫酸铜反应,铁与硫酸铜反应的化学方程式为:Fe+CuSO
4═FeSO
4+Cu,铁的相对原子质量为56,生成64g铜消耗的铁的质量为56g,小于65g;则锌、碳、铁的混合物与硫酸铜反应生成64g铜所需金属混合物的质量有可能为65g,故选项正确.
故选AD.
点评:本题主要考查学生利用化学方程式进行计算和分析的能力,解题的关键是采用极端假设法对混入的金属进行分析找到可能的组合.

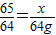 x=65g
x=65g

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案